
Ett fossilt exemplar av T. rex (AMNH 5027) som visas på American Museum of Natural History, år 2019. Kredit:Naturhistoriska riksmuseet, New York City. amnh.org/exhibitions/permanent/saurischian-dinosaurs/tyrannosaurus-rex.
Den befintliga uppfattningen att mjukvävnadsarkitekturer och naturliga proteiner kan bevaras över geologisk tid är kontroversiell eftersom metoder för sådant bevarande återstår att undersöka och väldefinierade. I en ny studie, Elizabeth M. Boatman och kollegor vid avdelningarna för teknik, Paleontologi, Biologisk vetenskap, Material och teknik och den avancerade ljuskällan i USA, testade tvärbindningsmekanismer för bevarad vävnadsarkitektur. De använde två icke-enzymatiska, strukturella proteinmekanismer, Fenton kemi och glykation för att visa deras möjliga bidrag till att bevara blodkärlsstrukturer som återvinns från det kortikala benet av Tyrannosaurus Rex ( T Rex ; USNM 555 000, tidigare MOR 555). De visade endogeniteten (slumpmässigheten) hos de fossila kärlvävnaderna och närvaron av typ I-kollagen i de yttersta kärllagren med hjälp av bildbehandling, diffraktion, spektroskopi och immunhistokemi.
De härledde data från synkrotron Fourier transform infrared (SR-FTIR) studier på T Rex kärl för att analysera deras tvärbindningskaraktär och jämförde dem med kontrollkycklingprover behandlade på liknande sätt med de två teknikerna. Forskarna tillhandahöll röntgenmikrosondanalyser av det kemiska tillståndet hos de fossila vävnaderna för att stödja kärlbevarande av T Rex , som observerats med hjälp av undersökningsmetoderna. Boatman et al. föreslår att de observerade vävnadsstabiliserande tvärbindningarna kommer att spela en viktig roll för att bevara ytterligare mikrovaskulära vävnader i skelettelement från den mesozoiska eran. Verket är nu publicerat på Vetenskapliga rapporter .
Paleontologer har återhämtat sig ihåligt, böjliga och transparenta kärlliknande strukturer från skelettelement från fossila ryggradsdjur inklusive icke-fågeldinosaurier och tillämpade många tekniker för att identifiera deras endogena proteiner som kollagen och elastin. Forskare hade använt masspektroskopisekvensering för att identifiera isolerade kärl som återvunnits från icke-fågeldinosaurier för att stödja närvaron av ryggradsspecifika vaskulära proteiner tidigare. Till exempel, de dokumenterade det kännetecknande 67-nanometer-bandmönstret som är typiskt för typ I kollagen efter att ha frigjort proteinet via demineralisering, följt av ytterligare studier för att verifiera förekomsten av typ I-kollagen i vaskulära kanaler i ett sauropod-dinosauriervben från cirka 190 miljoner år sedan med hjälp av FTIR- och Raman-analys. Medan forskarlag hade utvecklat en mängd olika metoder för att förklara oväntad bevarande, experimentell testning av föreslagna mekanismer återstår att utföras rutinmässigt och brett.
I detta arbete, Boatman et al. identifierade och testade det möjliga bidraget från en uppsättning experiment för att bevara den kärlliknande arkitekturen hos det kompakta benet i en Tyrannosaurus Rex fossil. De förväntar sig att arbetet ska lägga en möjlig grund för ytterligare studier om att bevara mjukvävnader som återvunnits från mesozoiken eller nyare fossiler. Väggarna i ryggradsdjurets blodkärl innehåller tre distinkta lager inklusive tunica intima (innersta), tunica media och tunica externa (yttersta lagret). På grund av deras unika molekylära sammansättningar, forskare kan differentiera beståndsdelarna morfologiskt och kemiskt. Till exempel, elastin är ett spiralformigt protein specifikt för ryggradsdjur som ger motstånd mot tryckförändringar i kärlväggarna. Kollagen är också ryggradsspecifikt och utgör en övervägande del av blodkärlen för att fungera som deras strukturella grund. Eftersom elastin och kollagen innehåller kännetecken som kan identifieras i den molekylära strukturen och sammansättningen, Boatman et al. föreslog att studera de två proteinerna i de kvarvarande dinosauriekärlen.
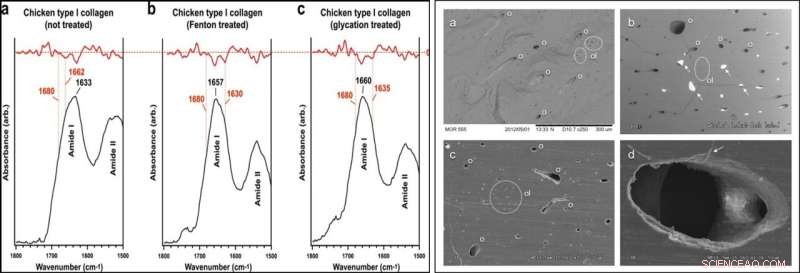
VÄNSTER:SR-FTIR-analys. Amid I sub-band lokalisering av obehandlad och behandlad kyckling typ I kollagen i SR-FTIR spektra. Underband (β-ark, ~1633 cm−1; trippelhelix, ~1658–1660 cm−1; intermolekylär, ~1683–1690 cm−1) anges i figurerna. Röda spår anger andraderivator av experimentkurvor. Även om det intermolekylära subbandet vanligtvis uppträder vid lägre vågtal, det identifierade värdet var det närmaste lokala minimum i vart och ett av de andra derivatspåren och förekommer konsekvent i alla prover; därför, i detta prov, det intermolekylära subbandet indexerades till 1697–1699 cm−1. HÖGER:SEM-bilder av USNM 555000 kortikalt ben. (a) Frakturyta som visar tydliga egenskaper hos osteoner (o) huvudsakligen i längsgående sektion, osteocytlacuner (ol; i streckade vita cirklar), och fin textur som överensstämmer med mineraliserade kollagenfibrer i ben. Bakåtspridd (BSE) bild. (b), Polerad (1200 grit) tvärsnitt (BSE-bild) som visar tydliga egenskaper hos osteoner och osteocytluckor. Mineralfyllda osteoner (vita pilar) ger kraftigt förändrade kärlstrukturer, som lätt eliminerades från SAXS, FTIR, och TEM-analys genom noggrann förberedelse (sedimentering, tvättning, urval under mikroskop). Sprickor beror på fukt-/tryckförändringar och är en artefakt av förberedelse. (c), Polerad (1200 grit) tvärsnitt (sekundär elektron [SE] bild) som visar tydliga drag av osteoner och osteocytluckor. (d), Mycket förstorad SE-bild av en osteon, visar fibrös struktur vid kanterna (vit pil), som vanligtvis observerades i icke-mineralfyllda osteoner i detta prov. Denna tunna, fibrös beläggning inuti osteonstrukturen föreslås vara den ihåliga, böjliga kärlstrukturer. Kreditera: Vetenskapliga rapporter , doi:10.1038/s41598-019-51680-1
Forskargruppen antog bidraget från tidiga diagenetiska (fysiska och kemiska) processer till överlevnaden av T Rex mikrovaskulatur från djupet. För att testa detta, Boatman et al. utförde först SR-FTIR-analys för att förstå tvärbindningskaraktären i deras kontrollprov av kycklingtyp I-kollagenprotein. De inducerade tvärbindningar i proteinet med hjälp av Fenton-reagens eller jonkatalyserade glykeringstekniker följt av användningen av transmissions-SR-FTIR för att testa varje vävnad. De observerade att de intramolekylära tvärbindningarna som bildades i kycklingvävnaderna var omogna på grund av deras brist på exponering för vägar som är nödvändiga för att bilda intermolekylära tvärbindningar eller avancerade glykationsslutprodukter (AGEs).
För att testa T Rex kärlarkitektur för endogena proteiner, forskarna befriade tre typer av kärl från en avmineraliserad T Rex Kortikalt ben. De använde sedan synligt ljusmikroskopi (VLM) för att karakterisera dem som:
De kopplade energidispersiv röntgenspektroskopi (EDS) med svepelektronmikroskopi (SEM) samt mikrofokuserad röntgenfluorescensspektroskopi (µXRF) för att bekräfta skillnaderna som observerades i vävnadsprover med varierande sammansättning. Teamet fokuserade på de böjliga kärlnätverken på grund av att de liknar befintlig benvävnad, som förmodligen bibehöll minimal förändring.
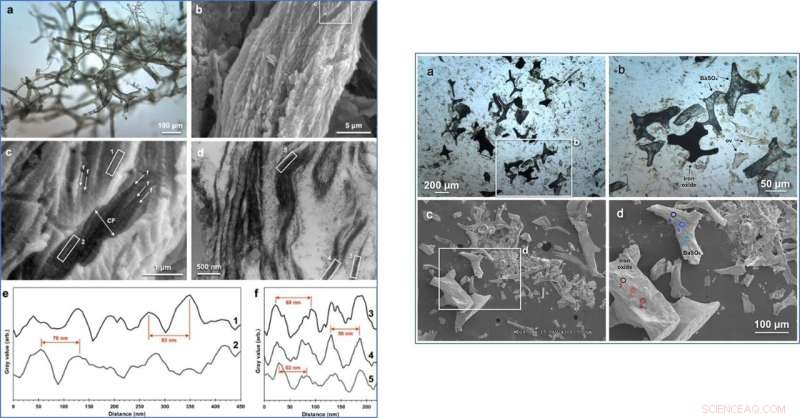
VÄNSTER:Mikroskopibilder av T. rex vaskulär vävnad och tillhörande analys av fibrillär kollagenband. (a) Överförd VLM av T. rex mjukvävnad visar ett omfattande nätverk av ihåliga, smidig, vaskulär struktur och typisk brun nyans. (b) SEM-bild av ytan på ett kärl. (c) Förstorad bild av (b) detaljerade egenskaper som överensstämmer med kollagenfiberknippen (kollagenfibrill, "f"; kollagenfiber, "CF"). Den genomsnittliga fibrillbredden mättes som 110 nm, och genomsnittlig fiberbredd, 1,0 μm. (d) TEM-bild av fibrösa egenskaper observerade i ett längsgående kärltvärsnitt. Intensitetsprofiler av bandad textur i (e) rutor 1 och 2 i c och (f) rutor 3, 4, 5 i (d) med exempel topp-till-topp-avstånd (SEM-medelvärde, ~74 nm; TEM, ~56 nm) ropade i rött. HÖGER:Bilder och kemisk analys av det organiska, brunfärgade Tyrannosaurus rex-kärl och mineraliserade avgjutningar av kärlsystemet som frigörs vid vävnadsavmineralisering. (a), Optisk mikroskopibild av typiska kärlfragment befriade från T. rex. (b), Förstorad bild av vit rektangel i en, föreställer brunfärgade, smidig, organiska kärlfragment (ov) och två typer av mineraliserade avgjutningar:ogenomskinliga former och halvgenomskinliga former. (c), SEM-bild av liknande kärlfragment. (d), Förstorad bild av vit rektangel i c, med tre kärlfragmenttyper identifierade och platser för EDS-analys i e explicit identifierade. (e), EDS-analys identifierade de ogenomskinliga kärlavgjutningarna som en järnoxidform (botten, röd) och det halvgenomskinliga kärlet gjuts som BaSO4 (överst, blå). Kreditera: Vetenskapliga rapporter , doi:10.1038/s41598-019-51680-1
När Boatman et al. studerade det böjliga T Rex fartyg som använder SEM, de observerade fibrösa strukturer över deras yttersta yta. De kombinerade egenskaperna överensstämde med de som observerades i befintliga kärl som frigjorts från kortikalt ben och med fibrillärt kollagen. Teamet analyserade SR-FTIR-spektrumet för T Rex kärl för att detektera de dominerande banden som observerats i både behandlade befintliga och gamla vävnader. I synnerhet, amid I-bandet för dinosaurievävnaden var lokaliserat vid en dominerande a-helixstruktur i överensstämmelse med moget (tvärbundet) fibrillärt kollagen. Forskargruppen genomförde sedan immunhistokemi (IHC) studier för att identifiera proteinspecifika epitoper av strukturproteinerna elastin och typ I kollagen.
Forskarna tog fram antikroppar mot alla komponenter i den befintliga kärlstrukturen för att observera positiv bindning i dinosauriens kärlväggar. Med hjälp av ett fluorescerande filter, de fångade lokaliseringen och distributionen av antikropp-antigenkomplex (grön fluorescens). Dinosauriekärlens svar på aktinantikroppar visade sig som ett tunt och jämnt fördelat lager. Antikroppar som tagits upp mot muskelproteinet tropomyosin uppträdde med större intensitet på kärlväggarna. Dinosauriekärlen indikerade också närvaron av typ I kollagenantikroppar, även om elastinantikroppar visade större intensitet. De två proteinerna var bra mål för fossilstudier på grund av hög evolutionär bevarande i vissa regioner. De observerade inte dinosauriekärlens reaktivitet mot antikroppar mot bakteriell peptidoglykan (vilket indikerar ingen mikrobiell kontaminering).
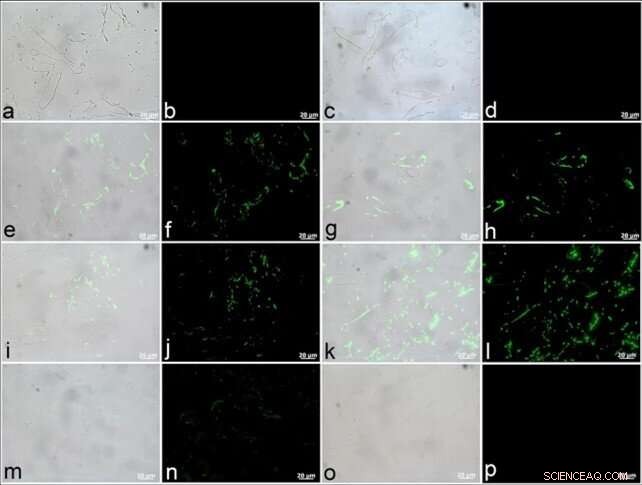
T. rex-vävnader uppvisar positiv antikroppsbindning till proteinkomponenter i befintlig vaskulär vävnad. (en, c, e, g, jag, k, m, o) Är sammansatta bilder där fluorescens som motsvarar antikropp-antigenkomplex överlagras på VLM-bilder av kärlsektioner, med intilliggande bilder (b, d, f, h, j, jag, n, p) fångas med ett fluorescerande filter. (a–d) Ingen falsk bindning observerades för negativa kontroller där kärl exponerades för sekundära antikroppar framtagna mot värdarterna för alla andra använda antikroppar, dvs. mus (en, b) och kanin (c, d). (e, f) Positiv bindning av dinosauriekärl till aktinantikroppar kan ses i tunna, jämnt fördelade lager, och (g, h) mer brett fördelad bindning är uppenbar för muskeltropomyosinantikroppar. Antikroppar mot båda (i, j) typ I kollagen och (k, l) elastin binder positivt till dessa T. rex-kärl. (m, n) Antikroppar framtagna mot strutshemoglobin uppvisar jämförelsevis lägre bindningsintensitet. (o, p) Ingen reaktivitet hos dinosauriekärl mot antikroppar mot bakteriell peptidoglykan observerades (vilket indikerar ingen kontaminering). Kreditera: Vetenskapliga rapporter , doi:10.1038/s41598-019-51680-1
Boatman et al. testat T Rex kärlstrukturer för att förstå om post-mortem strukturell proteintvärbindning förbättrade deras motståndskraft mot nedbrytning eller diagenetiska förändringar. För detta, de fokuserade på fibrillärt kollagen med användning av SR-FTIR-transmissionsspektra för att antyda tvärbindning efter slakt under processen för bevarande av vävnadsarkitektur. Dessa spektrala egenskaper har tidigare registrerats men inte diskuterats med sauropodomorfer från jura och kritaben. Forskarna behandlade sedan bulk T Rex vävnad med natriumborhydrid (NaBH 4 för att reducera karbonylgrupper inom omogna tvärbindningar och öka den icke-peptidbaserade karbonylabsorptionsintensiteten. Kolhydratabsorptionsbanden i T Rex vävnad överensstämde med AGEs (avancerade glykeringsslutprodukter). Efter behandling, uppgifterna antydde det T Rex vävnader hade både intramolekylära och intermolekylära tvärbindningstyper.
När forskarna kartlade elementen i vävnaden med hjälp av µXRF, de avslöjade järn (Fe) som den enda metallen koncentrerad i dinosauriekärlens vävnader medan de registrerade barium (Ba) i de halvgenomskinliga kärlavgjutningarna. Med hjälp av utökad mikroröntgenabsorptionsnära-kantstrukturmikroskopi, de observerade Fe 3+ inbäddade i kärlväggarna. Forskarna visade närvaron av finkristallin goetit (α-FeO(OH)); ett mineral som tidigare upptäckts i vaskulära vävnader som återvunnits från två olika dinosaurieexemplar.
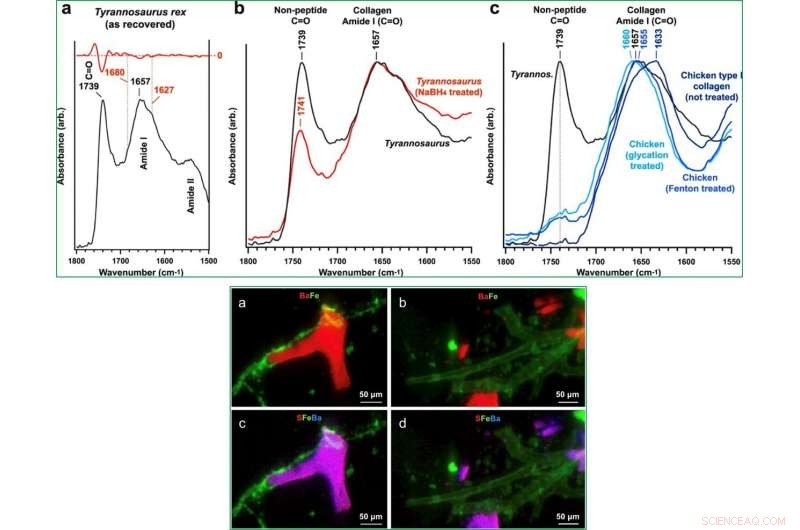
UPP:SR-FTIR-analys av T. rex vaskulär vävnad, NaBH4 reducerade T. rex vaskulär vävnad, kyckling typ I kollagen utan behandling, och kyckling typ I kollagen behandlad med Fenton reagens och järnkatalyserad glykering. (en, b) Genomsnittliga FTIR-spektra i icke-peptidkarbonyl- och proteinamid I-regionerna för alla fem proverna. (a) Betydande minskning av icke-peptidkarbonylbandet följer efter behandling av T. rex vaskulär vävnad med NaBH4, vilket minskar (omogna) peptidtvärbindningar. Det blåskiftade Amide I-bandet av dinosaurievävnaden, Fenton reagensbehandlad kyckling typ I kollagen, och Fe-katalyserad glykationsbehandlad kyckling typ I-kollagen indikerar ökande α-helixstruktur (~1660 cm−1) eftersom de högre energirika trippelhelix- och intermolekylära subbanden alltmer dominerar spektra. Utvecklingen av aldehydkarbonyl, ketoaldehyd, och/eller omogna ketoiminband i båda behandlade kycklingvävnaderna överensstämmer med det starka karbonylbandet i dinosaurievävnaden. NEDERST:Mikroröntgenfluorescens (u-XRF) kartläggning av organiska och mineraliserade Tyrannosaurus rex-kärlvävnader avslöjar närvaron av flera metaller. S, Fe, och Ba var de primära elementen som identifierades i kärlproverna. Sammansatta kartor av två (a, b visar Ba och Fe) och tre (c, d visa S, Ba, och Fe) atomarter visar att Fe övervägande är associerat med de organiska kärlvävnaderna, medan S och Ba huvudsakligen är förknippade med de halvgenomskinliga mineraliserade kärlgjutningarna. Kreditera: Vetenskapliga rapporter , doi:10.1038/s41598-019-51680-1
På det här sättet, Elizabeth M. Boatman och kollegor visade förekomsten av endogena proteiner av ryggradsdjurarter i dinosauriestrukturer i mjukvävnad. Detta inkluderade närvaron av typ I-kollagen i överensstämmelse med kärlstrukturen hos existerande ryggradsdjur. Data stödde en tvåstegsmekanism som stabiliserade biomolekyler och kärlarkitektur efter organismens död, för att främja deras bevarande inom skelettelement. The team hypothesized that iron-mediated Fenton and glycation pathways may have contributed to enhanced T. rex tissue longevity of elastin and fibrillar collagen within and around blood vessels. Both processes could be catalyzed by transition metal species such as iron to define the central role of Fe observed in structural protein crosslinking. The formation of iron oxyhydroxide precipitates in the work fully supported this idea.
The data represent the first comprehensive chemical and molecular characterization of vascular tissues recovered from T. rex specimen USNM 555000. The results shed light on the possible processes of fossilization at the molecular level. The researchers envision the demonstrated techniques will contribute to the development of comprehensive mechanisms to consistently retain vascular tissue survival from deep time.
© 2019 Science X Network