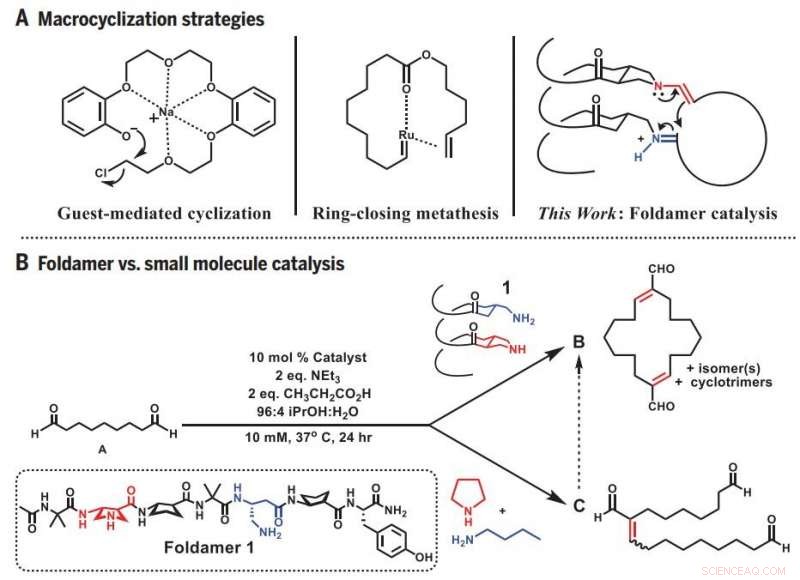
Makrocykliseringsstrategier. (A) Tidigare tillvägagångssätt och foldamer-metoden för makrocyklisering. (B) Divergent reaktivitet:Foldamer kontra småmolekylär katalys. ekv., motsvarighet(er). Kreditera: Vetenskap (2019).DOI:10.1126/science.aax7344
Inspiration från naturen, University of Wisconsin-Madison kemister har upptäckt ett effektivt sätt att bråka länge, slingrande molekyler för att bilda stora ringar – ringar som utgör ryggraden i många läkemedel men som är svåra att tillverka i labbet.
Arbetet kan representera preliminära framsteg mot att dechiffrera hur enzymer, finslipad av evolutionen, så effektivt producera naturliga föreningar. Mer omedelbart, den nya metoden kan hjälpa forskare att syntetisera läkemedel som har stora ringryggrader, såsom de för hepatit. Forskningen publiceras den 19 december i tidskriften Vetenskap .
Naturen föredrar störningen av en lång, flexibel molekyl i storleksordningen en stel ring, vilket gör det notoriskt svårt för kemister att få stora ringar att bildas i labbet. "Om de linjära molekylerna blir tillräckligt långa, det är som om ändarna inte längre vet att de är anslutna, och de är lika benägna att binda till andra molekyler som att de kommer samman, " säger UW-Madison professor i kemi Sam Gellman, den äldre författaren till rapporten.
Ändå kan biologiska enzymer lätt föra samman dessa ändar och bilda ringar av alla storlekar. De åstadkommer denna bedrift tack vare deras komplexa, tredimensionella former som fungerar som ett specialiserat lås – den linjära molekylen passar på plats som en nyckel på precis rätt sätt för att en organiserad reaktion ska kunna äga rum.
Att både studera hur enzymer fungerar och efterlikna deras förmågor, Gellmans team vände sig till mycket mindre, tredimensionella proteinliknande molekyler som kallas foldamers som deras labb har hjälpt till att utveckla.
Eftersom foldamern har en tredimensionell form som kan gripa tag i ändarna av den flexibla prekursormolekylen, det ökar avsevärt oddsen att ändarna hittar varandra. På samma gång, foldamern katalyserar den rätta reaktionen som länkar ändarna till en sluten ring. Resultatet är en enkel och förutsägbar syntes av en utmanande, och användbar, molekylär form.
"Som kemister, vi ser hur utomordentligt effektiva enzymer är på att utföra reaktioner som är svåra att åstadkomma i en kolv, men vi förstår inte riktigt hur de fungerar, " säger Gellman. "Om vi lär oss hur dessa små foldamer-katalysatorer fungerar, vi kanske kan bygga katalysatorer som är effektiva för många olika reaktioner. I sista hand, kanske kan vi starta oss mot foldamers som har verkligt enzymliknande aktivitet."
Doktorand och huvudförfattare Zebediah Girvin började forskningen genom att testa förmågan hos en kort, spiralformad foldamer. Girvin försökte använda foldamern för att böja en linjär molekyl som innehåller nio kolatomer så att den skulle bilda en ring. Men istället för en ring av den förväntade storleken, Girvin fick en dubbelt så stor - resultatet av att två prekursormolekyler först gick samman och sedan sluter cirkeln.
"Det här är en vanlig situation inom vetenskapen. Du försöker något och det fungerar inte som du förväntade dig, " säger Gellman. "Utmaningen är att känna igen när det överraskande resultatet är lika intressant som det ursprungliga målet, eller ännu mer intressant."
Styrd av denna serendipity, Girvin började testa hur väl foldamern kunde producera de större ringar som den verkade föredra att skapa. Han fann att han lätt kunde tillverka ringar som består av 12 till 22 kolatomer när foldamerns reaktiva platser, där ringen stängs, var uppradade med varandra på ena sidan. Denna orientering förde de två ändarna av olika linjära molekyler nära nog att smälta.
Som ett proof-of-concept för den nya tekniken, Girvin syntetiserade naturprodukten robustol från grunden. Kommer från bladen på den australiska silkeslen ek, robustol väger in med en rejäl 22-atoms ring.
Gellmans team är mest exalterade över potentialen för foldamers att katalysera andra användbara reaktioner och möjligen hjälpa till att reda ut långvariga mysterier om hur enzymer, naturens kemiska virtuoser, producera de molekyler som krävs för livet helt enkelt genom att ordna aminosyrabyggstenar i rätt form. Även om dessa svar är år borta, den ringslutande tekniken de har upptäckt kan ha mer omedelbar användning för att syntetisera drogkandidater. Hepatit C-läkemedlet vaniprevir, som används i Japan och i sent skede försök i USA, innehåller just den här typen av stor ring.
Foldamers verkliga potential härrör från deras mångfald. Kemister kan göra en nästan oändlig mängd foldamers i labbet eftersom de har tillgång till fler byggstenar än vad som finns i naturliga proteiner. Detta kan göra det möjligt för kemister att bygga mer användbara katalysatorer, vilket ledde till att Gellman patenterade vissa foldamers och hittade företaget Longevity Biotech för att utforska deras terapeutiska användningsområden.
Går framåt, att rikedom av alternativ kommer att tillåta forskare att arrangera dessa katalysatorer i former som sannolikt kommer att vara användbara på oväntade sätt. Bara mer forskning kommer att visa.
"Vi vet inte riktigt vad dessa katalysatorer är kapabla till ännu, " säger Girvin. "Det kommer att ta år att ta reda på deras potential, och det är viktigt att vi kastar ett brett nät och håller öppet sinne om vad vi kan åstadkomma med dessa nya verktyg."