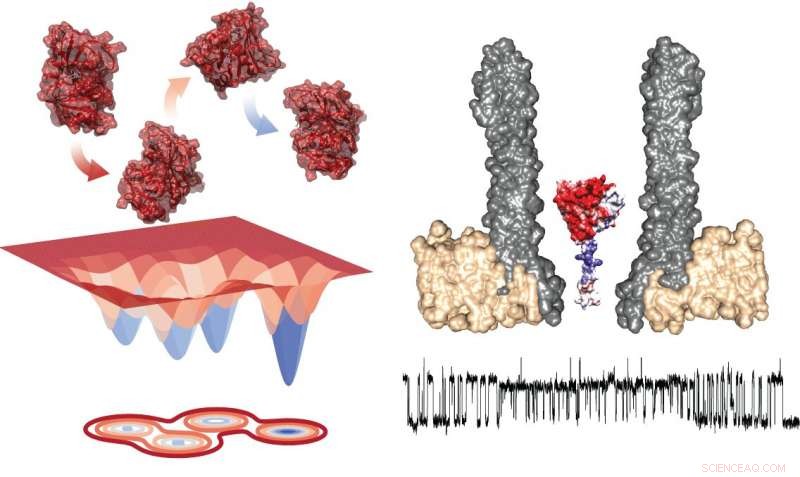
Energidiagram över de fyra konformerna (vänster) och den experimentella inställningen som visar nanoporen med det instängda enzymet i tvärsnitt (höger). Under, det finns ett typiskt spår som visar mätningar under utbyte inom rotamer. Upphovsman:Giovanni Maglia, University of Groningen
Forskare vid University of Groningen har observerat egenskaperna hos ett enda enzym i en nanopor. De lärde sig att enzymet kan existera i fyra olika vikta tillstånd, eller konformatorer, som spelar en aktiv roll i reaktionsmekanismen. Dessa resultat kommer att få konsekvenser för enzymteknik och utveckling av hämmare. Studien publicerades i Naturkemi den 6 april.
Enzymer är vikta proteiner som har en specifik tredimensionell struktur som skapar en aktiv plats som kan binda ett substrat och katalysera en specifik reaktion. Under de senaste åren har det har blivit klart att enzymer inte är stela strukturer, men att de vikta proteinerna existerar som en ensemble av konformationer i jämvikt runt ett energiskt stabilt marktillstånd.
Vind tunnel
Att studera övergången mellan stater kräver att man observerar enstaka enzymer under en längre tid, vilket är utmanande. University of Groningen Docent i kemisk biologi Giovanni Maglia utvecklade trattformade nanoporer som kan fånga upp proteiner. Genom att mäta jonströmmen över en sådan nanopor inbäddad i ett artificiellt lipidmembran, Maglia kunde observera konformationsförändringar i enzymer. "Du kan jämföra det med att studera en bil i en vindtunnel, "förklarar han." Om du öppnar ett fönster eller en dörr ändras luftflödet. På ett liknande sätt, en förändring i enzymets vikningsstruktur förändrar jonströmmen genom poren. "
Maglia använde sitt nanoporesystem för att studera enzymet dihydrofolatreduktas (DHFR), som omvandlar dihydrofolat till tetrahydrofolat. "Vi valde detta enzym eftersom det har studerats som ett modellsystem för enzymdynamik i över 30 år, använder alla tillgängliga tekniker. Dessutom, hämmare av detta enzym, såsom metotrexat, används som läkemedel mot cancer.
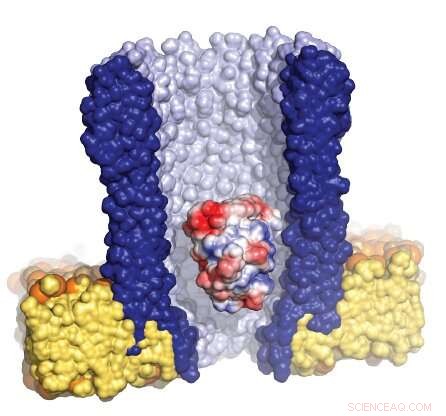
Illustration av den trattformade nanoporen (blå) omgiven av det artificiella membranet (gult), med ett enda enzym (röd/vit/blå) fångad inuti poren. Upphovsman:Giovanni Maglia, University of Groningen
Effektiv frigöring
Mätningar av DHFR avslöjade närvaron av fyra konformatorer med olika affinitet för substraten. Maglia säger, "Växlingen mellan dessa fyra tillstånd var väldigt långsam. Det betyder att du bara kan se dem i sådana här långvariga enkla enzymstudier."
Lägga till reaktionshämmaren metotrexat, som binder till enzymet, orsakade en mycket snabb övergång mellan tillstånd och förändrade enzymernas affinitet. "Vår slutsats är att enzymets reaktioner med olika föreningar ger fri energi för konformationsförändringar, säger Maglia.
Vidare, konformationsförändring förändrade också enzymens affinitet. Det här är vettigt, eftersom enzymet behöver binda två substrat och, efter att reaktionen slutförts, måste släppa båda. "Substratet och produkten är mycket lika molekyler, så enzymet måste ändra sin affinitet för en effektiv frisättning. "
Två stater
Baserat på dessa studier, Maglia kan se enzymet växla mellan två tillstånd:Efter bindning av substratet, NADPH driver reaktionen, som sedan ändrar enzymets konformation och därmed dess affinitet. Senare, bindning av ett nytt substrat för det tillbaka till det första tillståndet. "Detta förklarar två av de fyra konformerna som vi observerade; vi kan ännu inte förstå de andra två, "Säger Maglia. Det är omöjligt att härleda strukturell information från mätningarna.
Ändå, studien visar kraften i nanopore -teknik för att bestämma strukturella förändringar av enzymer. "Vi vet också nu att detta enzym har fyra olika jordtillstånd och måste växla mellan dem för att fungera." Detta lägger till en utmaning för enzymdesign:Detta bör inte bara producera ett reaktivt centrum, men det bör också tillåta nödvändiga konformationsändringar. Maglia:"Detta kan förklara varför artificiellt utformade enzymer ofta inte fungerar lika effektivt som naturliga enzymer." Till sist, studien kommer också att tillåta forskare att identifiera nya hämmande läkemedel som binder tätare till DHFR än metotrexat.