
Lissencephaly-1, eller Lis1 -protein, aktiverar dyneinmotorn så att den kan transportera cellulär last. Dyneinet växlar mellan "av" (vänster) och "på" (höger). Lis1 binder till dynein när det är på, förhindra att dyneinet växlar till ett "av" tillstånd. Upphovsman:Markus Lab/Colorado State University
Rörelse signalerar liv, och ingenstans är detta santare än i en levande cell. Miljontals proteiner och molekyler i var och en av våra celler böjer sig, resa och anpassa sig i ett komplext men orkestrerat mönster, regleras av generna som kodar vad som går var och när. Som en del av det mönstret, en viktig klass av proteiner som kallas dyneintransport och levererar olika cellulära laster mellan olika delar av cellen.
Colorado State University biokemiforskare Steven Markus är särskilt fascinerad av dessa stora, intracellulära motorproteiner som rör sig metodiskt längs ett nätverk av trådformiga spår som kallas mikrotubuli.
Hur viktigt är dynein? Om dynein skulle försvinna, vi skulle inte leva förbi några mitotiska cellindelningar. Och många neurologiska sjukdomar, inklusive en som kallas lissencephaly, är kopplade till defekter i dyneinfunktionen. Målet med många laboratorier, inklusive Markus, är att förstå varför.
Hans forskargrupp har gjort ett steg i den förståelsen genom att avslöja, i invecklade detaljer, mekanismen genom vilken en viss molekyl påverkar dyneinfunktionen. Medan det länge var känt att lissencephaly-1-genen, eller Lis1, påverkar dyneinaktivitet, detaljerna var oklara. Markus och hans team har avslöjat exakt hur Lis1 aktiverar dynein genom att förhindra dyneins förmåga att stänga av sig, stabilisera den i en "öppen, "ohämmad konformation.
Det nya fyndet flyger inför tidigare accepterade åsikter om att Lis1 fungerade som en hämmare av dynein. Enligt Markus labs nya studie, publicerad 27 april i Naturcellsbiologi , raka motsatsen är sant:Lis1 aktiverar dynein, arbetar för att kila in sig på ett sådant sätt att motorproteinet hindras från att vika sig till ett "av" tillstånd-vilket hämmar dess förmåga att auto-inhibera, forskarna förklarar.
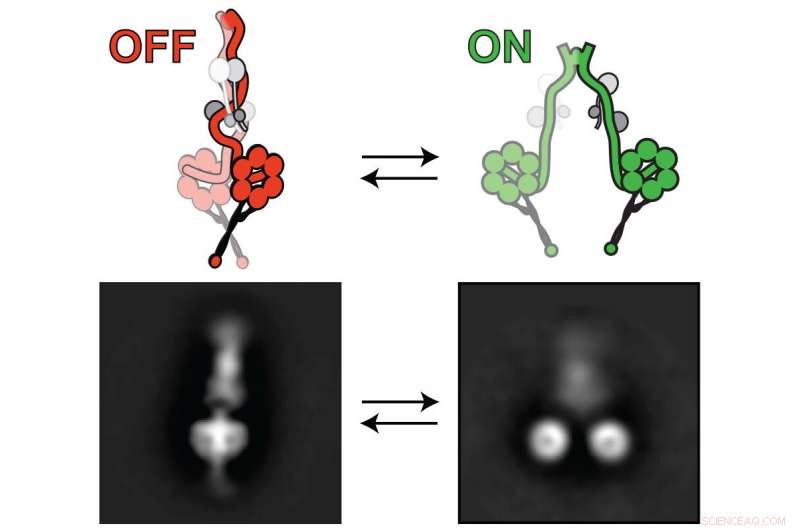
Forskarna använde en kombination av banbrytande tekniker för att dra sina slutsatser, inklusive högupplöst elektronmikroskopi. De använde detta för att visualisera dyneinmotorn i dess "av" (vänster) och "på" (höger) tillstånd. Upphovsman:Markus Lab/Colorado State University
Förstå molekylär grund för sjukdom
En person med lissencephaly, eller "slät hjärna, "drabbas av kramper och begränsad motorisk funktion och lever sällan efter några års ålder. Denna förödande sjukdom är förknippad med en mutation i Lis1, en gen som kodar för en kritisk regulator av dynein.
"Jag är intresserad av den molekylära grunden för dessa sjukdomar, "sade Markus, biträdande professor vid Institutionen för biokemi och molekylärbiologi. "Det kommer inte att finnas några terapeutiska ingrepp utan att förstå hur dessa molekyler fungerar." Bortom det, Markus säger, "Molekylmotorer är roliga, eftersom vi kan rena dessa motorer och se dem gå på mikrotubuli i realtid med hjälp av fluorescensmikroskopi " - vilket är precis vad laget gjorde för sin studie.
För att genomföra sina experiment, forskarna använde spirande jästceller som ett modellsystem. I motsats till mänskliga celler där dynein utför många aktiviteter, dynein utför bara en enda funktion i dessa celler. Deras resultat med detta förenklade system kan översättas till mänskliga och andra högre eukaryota celler, där den grundläggande dyneinfunktionen bevaras under miljontals år av evolution.
Forskarna använde flera tekniker för att dra sina slutsatser. Det viktigaste var enmolekylär avbildning i realtid. Med hjälp av en högavkastningsteknik som de utvecklade i labbet, teamet renade dynein, tillsatt en fluorescerande molekyl, och monterade mikroskopavbildningskammare med renade mikrotubuli för att titta på dynein "blixtlås längs, "Sade Markus. Denna teknik gjorde det möjligt för dem att fastställa rollen för den autoinhiberade konformationen i dyneinmotilitet.
De använde också elektronmikroskopi för att ta stillbilder med mycket hög upplösning för att avgöra om dyneinmolekylerna verkligen antog en auto-inhiberad konformation, vilket var oklart när de började sin studie. "På dag ett vid elektronmikroskopi -anläggningen, vi blev mycket förvånade över att se att dyneinmolekylerna entydigt befann sig i en autoinhiberad konformation, "Sa Markus." Den hade den så distinkta formen. "
Studiens huvudförfattare var före detta doktorand Matthew Marzo (nu postdoktor vid Columbia University), som utformade och ledde experimenten, med hjälp av medförfattare och dåvarande grundstuderande Jacqueline Griswold (nu doktorand och NSF-forskare vid Johns Hopkins School of Medicine).
Markus planerar att genomföra andra experiment, använder samma jästceller, att ytterligare undersöka Lis1:s roll i vad han och kollegor tycker är en flerstegsväg som aktiverar dynein. Han hoppas också kunna arbeta med neurovetenskapliga forskare vid CSU för att avgöra om Lis1 -aktiveringsmekanismen fungerar på samma sätt i neuroner. Där, målet blir att ge ännu mer kunskap om hur hjärnsjukdomar som lissencephaly uppstår på molekylär nivå.
Studien har titeln:"Pac1/LIS1 stabiliserar en ohämmad konformation av dynein för att samordna dess lokalisering och aktivitet."