Forskare vid Stanford University trodde att ett till synes tomt område i ena änden av Caulobacter -bakterien kan innehålla två proteiner som är involverade i celldelning. Genom att märka proteinerna med fluorescerande taggar och sedan avbilda samma prover med kryoelektrontomografi, de kunde bekräfta denna plats och visa exakt hur proteinerna var arrangerade. Upphovsman:Peter Dahlberg et al., PNAS , 8 juni 2020
Forskare har gift sig med två av dagens mest kraftfulla mikroskopitekniker för att göra bilder som visar, för första gången, identiteten och de exakta platserna för enskilda proteiner inom det detaljerade sammanhanget hos bakterieceller. Denna information är avgörande för att lära sig hur proteinmolekyler arbetar tillsammans för att organisera celldelning och utföra andra viktiga uppgifter, som att göra det möjligt för mikrober att nosa ut mat och fara.
Den nya metoden har redan upptäckt ny information om bakterieproteiner och deras närliggande mobilkvarter. Forskare säger att det också har potential att besvara grundläggande frågor om virusens molekylära maskiner, parasiter, och processer som fotosyntes.
"Detta är ett stort steg för biologin, och jag tror att det finns många, många system som kommer att dra nytta av denna typ av bildbehandling, "sade Stanford -professor Lucy Shapiro, vars forskargrupp deltog i studien.
Den nya hybridmetoden, kallas korrelerad avbildning genom annotering med enstaka molekyler, eller CIASM (uttalas "chasm"), utvecklades av Peter Dahlberg, en postdoktoral forskare i laboratoriet av professor W. E. Moerner vid Stanford University.
Det är en variant av en teknik som kallas lågtemperatur-enkelmolekylmikroskopi, uppfann av Moerner för tre decennier sedan, som fäster glödande etiketter till molekyler så att de kan identifieras individuellt. Denna metod ligger till grund för superupplöst fluorescensmikroskopi, ämnet Moerners Nobelpris i kemi 2014.
Vad Dahlberg gjorde var att hitta ett sätt att få denna typ av fluorescensavbildning att fungera vid minusgrader så att samma prover också kan undersökas med kryogen elektrontomografi (CET). CET använder elektronströmmar för att göra 3-D-bilder av flashfrysta celler och deras komponenter med nära atomupplösning. Genom att kombinera CET med fluorescerande avbildning kan forskare se de märkta molekylerna i den omgivande cellens sammanhang, ett avgörande perspektiv för att förstå deras roll i cellulära maskiner.
"Vi kan märka specifika molekyler av intresse så att ljuset vi ser bara kommer från dessa molekyler, och sedan hittar vi var de är inom cirka 10 nanometer, eller miljarddels meter. Detta ger oss en mycket mer exakt bild av vad som händer, "Dahlberg sa." Vi har tagit de ultraprecisa ögonblicksbilderna från CET och lagt till lite färg. "
Han lade till, "Det är spännande att utveckla nya avbildningsmetoder. När du är klar, du får ta ett steg tillbaka och titta på alla nya frågor du kan angripa. "
Med CIASM, forskargruppen kunde identifiera platserna för tre typer av proteiner i högupplösta CET-bilder av bakterier tagna vid Department of Energy's SLAC National Accelerator Laboratory. Resultaten rapporterades i Förfaranden från National Academy of Sciences i dag.
"Varje metod har sina fördelar och nackdelar, "Sade Moerner, "och det här är en trevlig situation där vi kan kombinera två metoder för att lära oss mer."
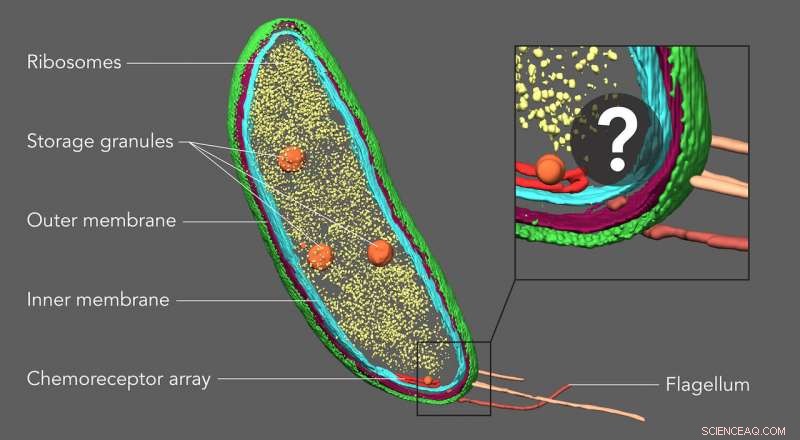
En roterande 3D -bild av den till synes tomma fickan i ena änden av en Caulobacter -cell visar nu de exakta platserna för PopZ -molekyler. Fickan ser klumpig ut eftersom den har färgats in manuellt för att markera området där forskare trodde att molekylerna kan vara, men kunde inte identifiera direkt med kryoelektrontomografi. Upphovsman:Peter Dahlberg et al., PNAS , 8 juni 2020
Hitta ordning i en cellulär soppa
Även i relativt enkla bakterieceller, platsen är allt, sa Saumya Saurabh, en postdoktor i Shapiros laboratorium som spelade en ledande roll i forskningen.
"Människor tenderar att tänka på bakterier som säckar med proteiner utan organisation, "sa han." Men det visar sig att det inte är sant, och faktiskt ligger många av molekylerna i bakterier exakt i både rum och tid. Om de inte är i rätt position, cellen dör. Vad Petes arbete äntligen tillåter oss att göra är att titta inuti med molekylär upplösning och ta reda på när och var dessa molekyler är placerade i förhållande till varandra. "
Caulobacter crescentus, till exempel, en välstuderad art av sötvattenbakterier, är känd för att dela upp sig i två väldigt olika typer av dotterceller:Den ena simmar fritt, medan den andra bildar en stjälk och fäster vid en yta. Hur varje dottercell får vad den behöver för att följa sin unika väg har varit ett länge mysterium.
Forskare hade tidigare identifierat små områden i vardera änden av delningscellen som kan innehålla proteiner som spelar nyckelroller i denna snedställda celldelning. Ett av proteinerna, PopZ, finns i båda ändarna av delningscellen, medan den andra, SpmX ("Spam-X") finns bara i den halva som kommer att utveckla en stjälk.
För denna studie, Saurabh och doktorand Jiarui Wang märkte proteiner i Caulobacter med fluorescerande taggar. Sedan frös Dahlberg dessa prover, utförde enkelmolekylfluorescensavbildning på dem med hjälp av doktoranden Annina Sartor, och tog dem till Stanford-SLAC Cryo-EM-anläggningarna för CET-avbildning regisserad av Wah Chiu, professor vid Stanford och SLAC.
Kartlägga en protein -hangout
De kombinerade bilderna bekräftade inte bara att båda proteinerna fanns i de områden forskare hade misstänkt, men avslöjade också exakt hur de var arrangerade:SpmX var inbäddad i cellens inre membran och stack ut i cellens inre, där den kom i direkt kontakt med PopZ.
"Den exakta orienteringen av detta proteinkomplex har diskuterats under de senaste 12 åren, "Saurabh sa." Vi kunde observera proteinpartnerna med utsökt upplösning. Nu har vi en mycket exakt bild av hur dessa proteiner talar till varandra i cellen. "
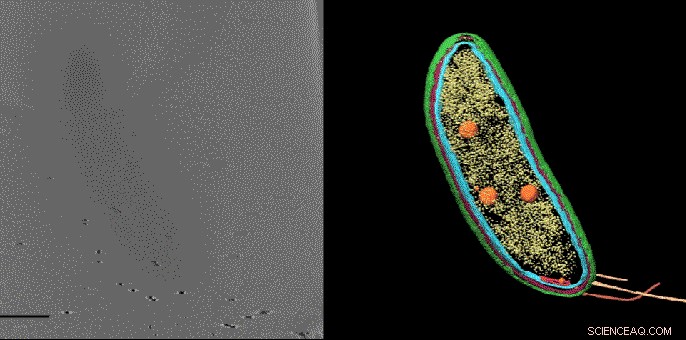
Med en teknik som kallas kryoelektrontomografi, forskare kan skapa detaljerade 3D -bilder av celler, som denna Caulobacter -bakterie, och markera deras komponenter - i det här fallet, cellmembranen (rött och blått), proteinskal (grönt), proteinfabriker som kallas ribosomer (gula) och lagringskorn (orange). Men tills nu, mindre strukturer och enskilda molekyler kunde inte identifieras och exakt placeras i dessa bilder. En ny bildteknik som utvecklats i Stanford fyller detta gap, avslöjar små molekyler som inte syns här. Upphovsman:Peter Dahlberg et al., PNAS , 8 juni 2020
Teamet testade CIASMs noggrannhet genom att använda det för att bekräfta placeringen av ett protein som heter McpA som var känt för att vara en del av en kemoreceptormatris i bakterierna. "Utsökt känsliga proteiner i denna grupp fungerar som Caulobacters näsa, "Sa Saurabh, "känner av den omgivande miljöens kemi så att de kan röra sig bort från obehagliga saker och gå mot glukosen de äter."
Arrayen visas som parallella svarta linjer i CET -bilder, och fluorescerande märkning av samma bilder identifierade platserna för enskilda McpA -proteiner inom cirka 10 nanometer.
En detaljerad titt på kvantprickar
I ett separat, parallellstudie, publicerad 24 april i Angewandte Chemie , forskarna använde en liknande teknik för att titta på enstaka kvantpunkter, med några överraskande resultat.
Quantum dots är nanoskala kristaller av halvledarmaterial som naturligt fluorescerar i färger som bestäms av deras storlek, form och sammansättning. Dessa prickar används i forskning för att märka och spåra proteiner och andra biologiska material, och har potentiella tillämpningar inom framtida elektronik, belysning, kvantberäkning, medicinsk bildbehandling och andra områden.
I den här studien, målet var att se hur de finare strukturella detaljerna för enskilda prickar var relaterade till specifika detaljer om deras optiska egenskaper, sa Davis Perez, en doktorsexamen student i Moerners labb.
"Vi kunde se några överraskande beteenden hos de enskilda kvantprickarna - till exempel i deras svar på excitation med laserljus, "sa han." Men den mest spännande aspekten för mig är att metoden vi utvecklat för att studera kvantprickar också kan användas för att studera biologiska system som fotosyntetiska proteiner, där energi överförs mellan grupper av proteiner, och se hur det fotosyntetiska maskineriet fungerar. "
Moerner sa att hans labb arbetar med Chiu för att driva dessa utmaningar.
"Det är de första dagarna att kombinera de två metoderna, och vi är glada över att utforska fler samarbeten som förbinder ljus och elektroner, "Chiu sa." Denna hybridbildmetod har potential att avslöja strukturer av molekylära komponenter som är involverade i viktiga biologiska processer i celler som spänner över alla livsområden. "