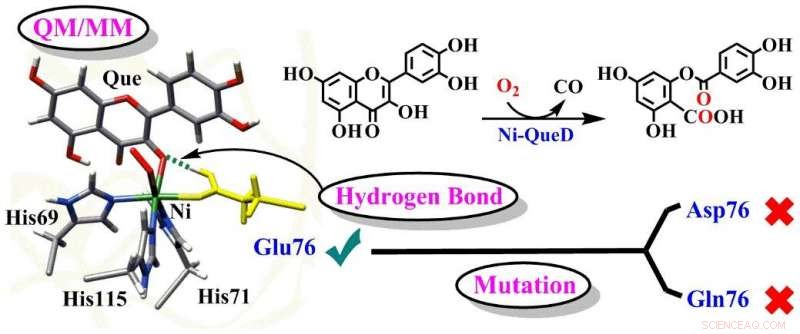
Schematisk illustration av de avgörande rollerna för Glu76-rester i Ni-QueD. Kredit:Prof. LI:s grupp
Katalytisk syreaktivering och selektiv oxidativ klyvning av C – C -bindningar har blivit forskningsområden inom kemi på grund av deras stora tillämpningsvärde i organisk syntes och industriell produktion.
Quercetin 2, 4-dioxygenases (QueDs), som ett typiskt metalloenzymbiologiskt system, effektivt kan aktivera dioxygen och selektivt katalysera oxidativ klyvning av C -C -bindning av organiska flavonolsubstrat under milda förhållanden. Även om studier på QueD har genomförts i årtionden, de detaljerade katalytiska mekanismerna för QueDs, särskilt Glu76 -restens roller på aktiv plats, är fortfarande under debatt.
I en studie publicerad i Journal of Catalysis , en grupp under ledning av professor LI Chunsen från Fujian Institute of Research on the Structure of Matter (FJIRSM) från Chinese Academy of Sciences rapporterade detaljerade reaktionsmekanismer katalyserade av vildtyp nickelberoende quercetin 2, 4-dioxygenase (Ni-QueD) och dess Glu76Asp- och Glu76Gln-mutanter med hjälp av kombinerade MD-simuleringar och QM/MM-beräkningar, och de avslöjade den kritiska rollen för Glu76-rester i styrningen av reaktiviteten hos Ni-QueD.
Forskarna fann att den bevarade nickel-ligerande Glu76-resten i deprotoniserad form är avgörande för att initiera den katalytiska reaktionen genom protonkopplad elektronöverföringsprocess.
Det genererade och protonerade Glu76 främjar den efterföljande reaktionen genom att reglera vätebindande (H-bindning) interaktion med karbonylgrupperna av quercetin.
Undersökningar av Glu76Gln- och Glu76Asp-mutanter visar att mutation av Glu76 undertrycker sådan H-bindningsinteraktion och resulterar i den lägre katalytiska aktiviteten som observerats experimentellt.
Denna studie ger inte bara användbar information om reaktionsmekanismerna katalyserade av metalljonberoende QueD, men också insikter om hur enzymer uppnår specifika reaktioner genom att använda H-bindningsinteraktionen från metallcentraliseringsresterna.