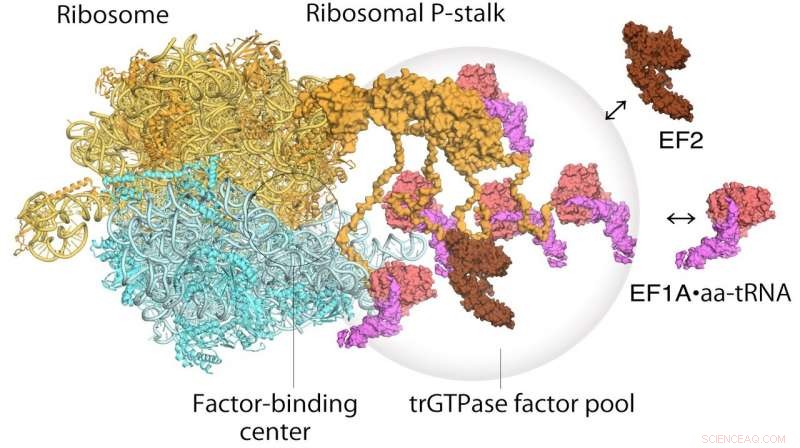
Modell för översättning av ribosomer och förlängningsfaktorer. EF1A • GTP • aatRNA och EF2 samlas till ribosomstjälken på den translaterande ribosomen. Translationsfaktorpoolen bidrar till effektiv proteinsyntes i en trång intracellulär miljö. Kreditera: Förfaranden från National Academy of Sciences
Ribosomer är komplexen av ribonukleoproteiner i hjärtat av proteinsyntesen i celler. Dock, i avsaknad av avgörande bevis, hur dessa komplex fungerar har varit öppet för debatt. Nu, Hirotatsu Imai och Noriyuki Kodera vid Kanazawa University, tillsammans med Toshio Uchiumi vid Niigata University i Japan, visa visualiseringar av den strukturella dynamiken och faktorpoolen som sker vid ribosomskaftsproteiner när de bygger nya proteiner.
Ribosomer upptäcktes först på 1950-talet, och deras breda funktion har varit allmänt förstått under en tid - de läser budbärar-RNA-sekvenser, och från det, generera sekvenser av korrekt ordnade aminosyror till nya proteiner. Ribosomstammproteinet spelar i synnerhet en integrerad roll i proteinsyntesprocessen genom att rekrytera proteinfaktorer som är ansvariga för translation och förlängning av aminosyrasekvensen. Dock, det har varit svårt att fastställa strukturen hos det bundna ribosomskaftsproteinet på grund av dess flexibilitet. Här, den höga upplösningen och snabba bildtagningen av höghastighets atomkraftsmikroskopi visade sig vara ovärderlig.
Atomkraftsmikroskopi använder en spets i nanoskala för att spåra proverna, ungefär som en vinylskivspelare som skannar över en skiva, förutom att detaljerna som identifieras av ett atomkraftmikroskop kan ha atomisk upplösning. Teknikens mångsidighet för olika ytor var redan en stor fördel för biologiska studier, men med tillkomsten av höghastighets atomkraftsmikroskopi, tekniken kunde fånga dynamiska processer för första gången, också. Imai, Uchiumi och Kodera använde tekniken för att avslöja att stjälkproteinet faktiskt växlar mellan två konformationer - en som överensstämmer med tidigare strukturella modeller och en helt oväntad ny konformation.
När det gäller hur ribosomen fungerar, en tvåstegsmekanism hade tidigare föreslagits för att beskriva hur genetisk information översätts genom proteiner som kallas translationella GTPas-faktorer. Det första steget är rekryteringen av faktorerna till faktorbindningsstället på proteinstjälken, därigenom ökar koncentrationen av faktorer där — så kallad faktorpoolning. Det andra steget är bindning och stabilisering av ett translationellt GTPas på det ribosomala faktorbindande centret för att katalysera GTPas-hydrolys. Från deras höghastighets atomkraftmikroskopistudie, forskarna kunde erhålla de första visuella bevisen för den translationella GTPase-faktorpoolningsmekanismen genom den ribosomala stjälken.
Även om studien inte kunde ge avgörande bevis för de faktorer som en gång var bundna, forskarna noterade att faktorerna verkade finnas kvar i närheten när GTPase-hydrolysen var fullständig, vilket tyder på en potentiell roll för stjälkproteinet i ytterligare stadier av proteinsyntes. Forskarna drar slutsatsen, "Framtida arbete med HS-AFM kommer att ge ytterligare viktig information för att förstå det dynamiska beteendet hos dessa komplexa översättningsmaskiner."