Läkemedel som innehåller guld har använts i århundraden för att behandla tillstånd som reumatoid artrit. Dessutom, de kan vara effektiva mot cancer och hiv. En mekanism genom vilken de fungerar kan uppstå eftersom guldjoner tvingar zinkjonerna ur zinkfingrarna - öglor, nukleinsyrabindande proteindomäner. Amerikanska forskare har karaktäriserat sådana "guldfingrar" med masspektrometri med jonmobilitet. Som rapporterats i tidningen Angewandte Chemie , de identifierade de exakta guldbindningsställena.
"Zinkjonerna i zinkfingrarna binder till fyra svavel- eller kväveatomer i proteinets cystein- och histidinrester, "förklarar Nicholas P. Farrell från Virginia Commonwealth University (Richmond, USA). "Guldjoner binder till bara två aminosyrafragment och ändrar proteinets form." Guldfingrarna "kan inte längre binda till nukleinsyror, som kan vara terapeutiskt användbar. "
Även om det finns en mängd olika bindningsställen för metalljoner, varje metalloprotein föredrar vanligtvis en enda konformation. Det var tidigare inte möjligt att bestämma var de specifika bindningsställena var i en blandning av konformatorer. Farrell och hans team har nu noggrant undersökt två guldfingrar. Enligt Farrell, "byte av zink i zinkfinger 3 av Sp1 -transkriptionsfaktorn leder till endast en enda guldfingerart." Forskarna identifierade detta som att ha en linjär Cys-Au-His-bindning. När det gäller HIV -nukleokapsidproteinet, som spelar en avgörande roll i replikationen av viruset, "sätta guld i zinkfingret 2 i proteinet (NCp7-F2), leder till tre olika guldfingerarter med linjära Cys-Au-Cys-motiv, varav en är klart dominerande. "
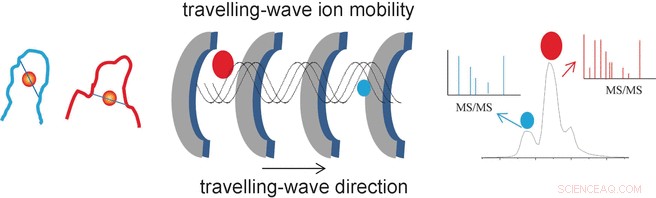
Forskarnas framgångar härrör från deras användning av en speciell analysmetod som kallas resande-våg-jonmobilitetsmasspektrometri (TWIM-MS). I denna teknik, molekylerna som ska analyseras joniseras och jonerna accelereras av ett elektriskt fält i en gas. Kollisioner med gasmolekylerna gör att jonerna saktas ner. Stor, omfattande molekyler bromsas mer än små, kompakta eftersom de kolliderar oftare. Detta gör det också möjligt att differentiera och separera isomerer, för även om de har samma massa, deras olika geometrier resulterar i olika rörlighet. När de separerats efter deras rörlighet, de enskilda jonerna kan nu fragmenteras genom kollisionsinducerad dissociation (CID) och fragmenten mäts igen med masspektrometri. Detta gör det möjligt att karakterisera kortare peptider som förblir bundna till guld.
"På det här sättet, vi kunde identifiera de specifika bindningsställena och lägena för de guldmodifierade zinkfingrarna NCp7-F2 och Sp1-F3, "säger Farrell." Masspektrometri för jonmobilitet ger således viktig information om förändringarna i geometri som orsakas av utbyte av zink i zinkfingerproteinerna, liksom selektiviteten och reaktiviteten hos sådana reaktioner. Detta kan vara en fördel i sökandet efter nya metallbaserade antivirala och antitumörläkemedel. "