
Kristaller av AR3 observerade under polariserat ljus (vänster). Kredit:Upphovsrätten för bilderna åvilar upphovsmännen enligt Nature Communications villkor
För första gången, ett internationellt team av forskare har visualiserat det ljuskänsliga proteinet archaerhodopsin-3 (AR3) med oöverträffad upplösning med hjälp av I24- och B23-strållinjerna vid Diamond Light Source. Fotoreceptorn uttrycks av Halorubrum sodomense, en organism som växer i Döda havet, men är mest känd för sina tillämpningar i optogenetiska experiment, där den används för att tysta enskilda neuroner och för att upptäcka förändringar i cellmembranspänningen. Dessa nya strukturer öppnar vägen för utveckling av nya verktyg och metoder inom neurovetenskap, cellbiologi och vidare.
I deras tidning, publiceras idag i Naturkommunikation , teamet rapporterar den första strukturen någonsin för grundtillståndet för AR3. I detta tillstånd, proteinet är konfigurerat att transportera en H + jon över cellmembranet för varje foton som absorberas. Teamet kunde också kristallisera fotoreceptorn i en andra konformation, ett desensibiliserat tillstånd som antas av AR3 i långvarig frånvaro av ljus.
Motsvarande författare Prof. Anthony Watts från Oxford University säger; "Den fantastiska upplösning som vi har uppnått för dessa AR3-strukturer, 1,07 Å för grundtillståndet, är bland de högsta för ett vildtypsmembranprotein som hittills deponerats i proteindatabanken. Denna kvalitet tillåter oss att direkt visualisera den komplexa fördelningen av vattenmolekyler inuti receptorn och beskriva den funktionella betydelsen av de invecklade nätverken av vätebindningar som de bildar, något som är viktigt i många biomolekyler – inte bara fotoreceptorer. Dessa nätverk i AR3 involverar interaktioner med retinalgruppen och aminosyrasidokedjorna och, i det här pappret, vi har visat hur de förändras mellan marken och desensibiliserade tillstånden hos proteinet."
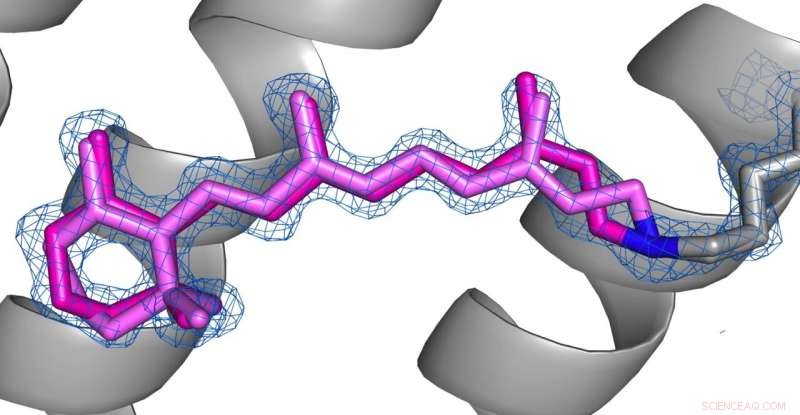
Jämförelse av konformationerna av retinal (rosa) i desensibiliserat tillstånd (bild 1) och grundtillstånd (bild 2) av AR3. Kredit:Upphovsrätten för bilderna åvilar upphovsmännen enligt Nature Communications villkor
Förklara betydelsen av AR3-proteinet, den första författaren Dr Juan Francisco Bada Juarez kommenterar; "Den spännande utvecklingen inom optogenetik under det senaste decenniet har lett till ett intensivt intresse för AR3 från forskare över hela världen. Mutanter av proteinet används rutinmässigt i neurovetenskapliga experiment för att selektivt tysta enskilda nervceller och även för att upptäcka förändringar i transmembranspänning. , dessa mutanter har designats utan kunskap om själva proteinets struktur. Våra data ger strukturbiologer och proteiningenjörer "ritningarna" till AR3 och, som ett resultat, vi kan förvänta oss en betydande acceleration i utvecklingen av nya optogenetiska verktyg."
Medförfattaren Dr Isabel Moraes från National Physical Laboratory (NPL) tillägger:
"Diffraktionsdatan med mycket hög upplösning har gjort det möjligt för oss att i detalj observera rörelsefriheten för flera viktiga aminosyror och enskilda vattenmolekyler inuti fotoreceptorn. Att lösa AR3-strukturerna var extremt utmanande, på grund av komplexiteten hos de egenskaper som vi kan urskilja vid atomär upplösning. Många aminosyrasidokedjor inuti proteinet löstes i mer än en position eller orientering, indikerar deras betydelse för proteinfunktionen. Kunskap om dynamiken i dessa grupper var nyckeln till att förstå hur processerna för sensibilisering och desensibilisering äger rum."
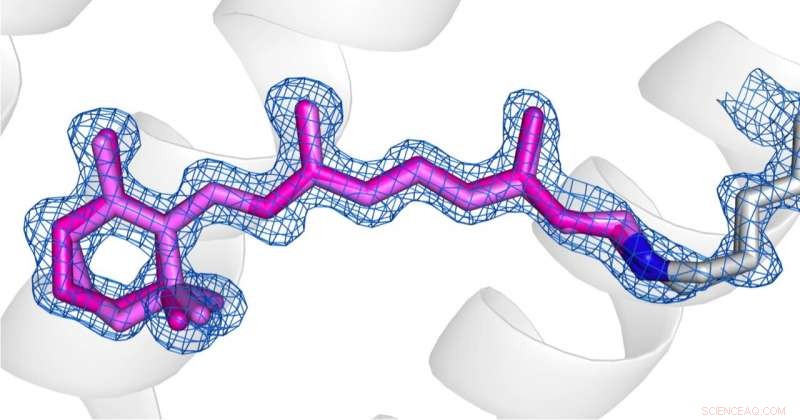
Jämförelse av konformationerna av retinal (rosa) i desensibiliserat tillstånd (bild 1) och grundtillstånd (bild 2) av AR3. Kredit:Upphovsrätten för bilderna åvilar upphovsmännen enligt Nature Communications villkor
Viktigt för att förstå hur proteinet fungerar, var de högupplösta kristallstrukturerna som teamet löste. Att erhålla sådana högkvalitativa diffraktionsdata skulle inte ha varit möjligt utan den toppmoderna mikrofokusstrållinjen vid Diamond Light Source, Storbritanniens nationella synkrotron, nära Didcot i Oxfordshire. Teamet arbetade nära flera experter på Diamond.
"Mikrokristallerna som odlades av Oxford- och NPL-teamen var perfekt lämpade för funktionerna hos I24-strållinjen. Med hjälp av programvara utvecklad av DIALS-programvaruutvecklingsgruppen på Diamond, vi kunde kombinera diffraktionsbilder från flera kristaller för att få kompletta datamängder. Kombinationen av exakt mikrofokus röntgenleverans och avancerad dataanalys gjorde det möjligt för oss att pressa upplösningen av de resulterande strukturerna till det yttersta, säger Diamond Senior Beamline Scientist Dr. Danny Axford.
Avslutningsvis tillägger prof. Watts:"Detta har varit en fascinerande studie. Det har varit ett nöje att arbeta med så många expertkollegor både i Storbritannien och runt om i världen. Nu har vi inte bara en mycket detaljerad kunskap om strukturerna för två viktiga funktionella tillstånd för AR3, men de insikter vi fått fördjupar vår förståelse av hur processerna för sensibilisering och desensibilisering sker i många andra receptorproteiner."