En konstnärs tolkning av energibarriären som en reagensfluoratom måste passera när den kolliderar med en fluormetylmolekyl på väg att bilda en produkt som ett resultat av en kemisk reaktion. Forskare vid University of Toronto observerade "knock-on" kolinjär utstötning av reaktionsprodukten (omgiven i blått) i fortsättningen av riktningen för den inkommande reagensmolekylen (omgiven i rött). Kredit:Lydie Leung
Forskning av ett team av kemister vid University of Toronto, ledd av Nobelprisvinnande forskaren John Polanyi, kastar nytt ljus över beteendet hos molekyler när de kolliderar och utbyter atomer under kemisk reaktion. Upptäckten ställer tvivel på en 90 år gammal teoretisk modell av beteendet hos "övergångstillståndet", mellanliggande mellan reagenser och produkter i kemiska reaktioner, öppna ett nytt forskningsområde.
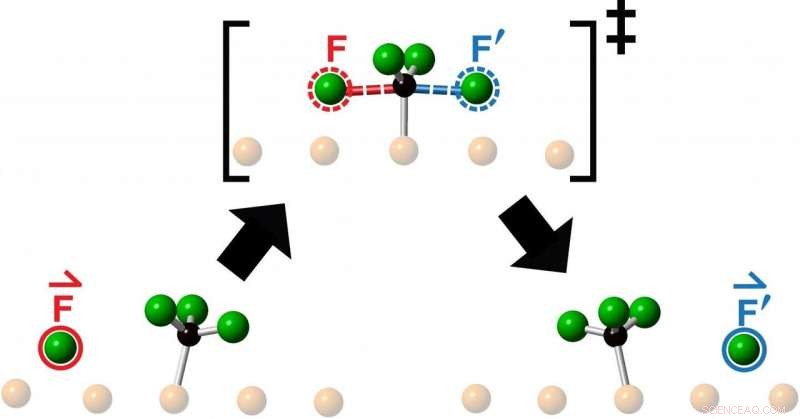
Forskarna studerade kollisioner som erhölls genom att lansera en fluoratom i mitten av en fluormetylmolekyl – som består av en kolatom och tre fluoratomer – och observerade den resulterande reaktionen med Scanning Tunneling Microscopy. Vad de såg efter varje kollision var utstötningen av en ny fluoratom som rörde sig kolinjärt längs fortsättningen av den inkommande fluoratomens närmanderiktning.
"Kemister kastar hela tiden molekyler mot andra molekyler för att se vad som händer eller i hopp om att göra något nytt, säger Polanyi, Universitetsprofessor vid institutionen för kemi vid fakulteten för humaniora och naturvetenskap vid U of T och senior författare till en studie publicerad denna månad i Kommunikationskemi . "Vi fann att rikta en reagensmolekyl mot mitten av en målmolekyl, begränsar rörelsen för den framväxande produkten till en enda linje, som om produkten hade blivit direkt "knackad". Den överraskande observationen att reaktionsprodukten kommer fram i en rak linje, rör sig i samma riktning som den inkommande reagensatomen, antyder att rörelserna som leder till reaktion liknar enkel vidare överföring av momentum.
"Bevarandet av linjärt momentum vi observerar här antyder ett kortlivat 'övergångstillstånd', snarare än den tidigare uppfattningen att det finns tillräckligt med tid för randomisering av rörelse. Newton skulle, Jag tror, har varit nöjda med att naturen tillåter en enkel knock-on händelse för att beskriva något så komplext som en kemisk reaktion, säger Polanyi.

University of Toronto doktorand Matthew Timm förbereder skanningstunnelmikroskop för ett experiment som kontrollerar resultatet av en kemisk reaktion genom att välja påverkansparametern för molekylära kollisioner. Kredit:Diana Tyszko
Laget, som inkluderade senior forskarassistent Lydie Leung, doktorand Matthew Timm och Ph.D. examen Kelvin Anggara, hade tidigare etablerat sättet att kontrollera om en molekyl som sänds mot en annan antingen frontalkrockar med sitt mål eller missar med en vald mängd - en kvantitet som kallas anslagsparametern. Ju högre effektparameter, ju större avstånd med vilket den inkommande molekylen missar målmolekylen. För det nya arbetet, forskarna använde en effektparameter på noll för att ge frontalkollision.
"Vi kallar den här nya typen av endimensionell kemisk reaktion "knack-på", eftersom vi upptäcker att produkten knackas på i fortsättningen av reagensriktningen, ", säger Polanyi. "Rörelserna liknar påslaget av stålkulorna i en Newtons vagga. Vaggans stålkulor passerar inte genom varandra, men överför effektivt fart längs en enda linje.
"Liknande, våra knock-on-reaktioner överför energi längs rader av molekyler, vilket gynnar en kedjereaktion. Denna bevarande av reaktionsenergi i knock-on kemi kan vara användbar när världen går mot energibesparing. Tills vidare, det fungerar som ett exempel på kemisk reaktion när den är som enklast."
Det har varit känt i över ett sekel att det finns en energibarriär som kemiska reagenser måste passera på vägen till att bilda reaktionsprodukter. Ett strömsatt övergångstillstånd existerar kort överst på barriären i en kritisk konfiguration - inget övergångstillstånd, ingen reaktion.
Polanyi säger att observationen av kolinjär "knock-on" ger insikt i det reaktiva kollisionskomplexet, som varar i ungefär en miljondels sekund. "Våra resultat säger oss tydligt att övergångstillståndet på toppen av energibarriären varar så kort tid att det inte helt kan förvränga sitt momenta. Istället, den kommer ihåg riktningen från vilken den attackerande fluoratomen kom."
På 1930-talet kemister började beräkna sannolikheten för att bilda ett övergångstillstånd under antagandet att det förvränger sin energi, som en het molekyl. Även om det var ett antagande, den verkade väletablerad och gav upphov till den statistiska "övergångstillståndsteorin" om reaktionshastigheter. Detta är fortfarande den föredragna metoden för att beräkna reaktionshastigheter.
"Nu, med förmågan att observera reagenserna och produkterna på molekylär nivå, man kan se exakt hur reagenserna närmar sig och därefter hur produkterna separeras, ", säger Polanyi. "Men detta strider mot den klassiska 90-åriga statistiska modellen. Om energin och momentumet randomiserades i det heta övergångstillståndet, produkterna skulle inte uppvisa ett tydligt minne av reagensens närmande. Energirandomisering skulle fungera för att radera det minnet."
Forskarna säger att den observerade riktningsrörelsen hos reaktionsprodukterna gynnar en deterministisk modell av övergångstillståndet för att ersätta den långvariga statistiska modellen. Dessutom, den observerade reaktionsdynamiken tillåter att reagensenergin förs vidare i på varandra följande kollinjära kollisioner.