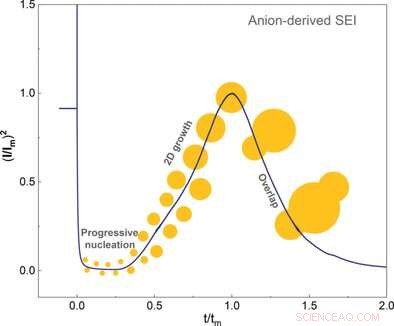
© Wiley-VCH. Kredit:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494
Batterier laddas och laddas upp – uppenbarligen allt tack vare ett perfekt samspel mellan elektrodmaterial och elektrolyt. Dock, för idealisk batterifunktion, den fasta elektrolytinterfasen (SEI) spelar en avgörande roll. Materialforskare har nu studerat kärnbildning och tillväxt av detta lager i atomär detalj. Enligt studien publicerad i tidskriften Angewandte Chemie , egenskaperna hos anjoner och lösningsmedelsmolekyler måste vara välbalanserade.
I litiumjonbatterier, SEI-formuläret i början av den första laddningsprocessen, när en potential tillämpas. Element från elektrolyten avsätter sig på grafitelektroden och bildar en beläggning som snart täcker hela elektroden. Först efter att detta lager är färdigt, kan de positiva litiumjonerna interkaleras i elektroden utan att exfoliera elektrodmaterialet.
Qiang Zhang och kollegor vid Tsinghua University, Peking, Kina, har nu tittat närmare på kärnbildningen och tillväxten av SEI. Elektrolyten i litiumjonbatterier innehåller litiumsalt och ett lösningsmedel. Starkt solvaterande lösningsmedel omsluter litiumjonen, och anjonerna flyter fritt. I kontrast, svagt solvaterande elektrolyter möjliggör en närmare anslutning av anjonerna till litiumjonen. Här, anjonerna förblir en del av det inre solvatiseringsskalet.
Detta inre solvatiseringsskal måste tas av från litiumet för att möjliggöra SEI-bildning och tillväxt. Forskarna visade att anjonerna i det inre skalet först adsorberades vid den färska elektroden och sedan tog upp två elektroner i en elektrokemisk reaktion. Denna senare händelse utlöste nedbrytning och kärnbildning av SEI. Författarna drog slutsatsen att SEI-bildningen främst berodde på hur lätt anjonerna kan fånga elektroner och sönderdelas jämfört med lösningsmedlet.
Forskarna använde elektrokemiska tekniker och atomkraftsmikroskopi för att undersöka kristalltillväxten tills skiktet var färdigt. De fann att ett slätt lager endast bildades vid låga överpotentialer. Lösningsmedlet påverkade också överpotentialen. Författarna noterade också att lösningsmedel med hög affinitet till det kristallina skiktet inte gav någon överpotential alls.
De drog slutsatsen att framtida design av högpresterande elektroder borde fokusera mer på samspelet mellan de negativa jonerna i litiumsaltet och lösningsmedlet. För att tillåta en homogen oorganisk, kristallint SEI som ska bildas, anjonerna bör konkurrera ut lösningsmedlet; de bör lättare adsorbera till elektrodytan och utföra elektrokemiska reaktioner. Dessutom, nedbrytningsprodukterna bör vara fasta och olösliga, men ändå visa en viss affinitet till lösningsmedlet, sa författarna.