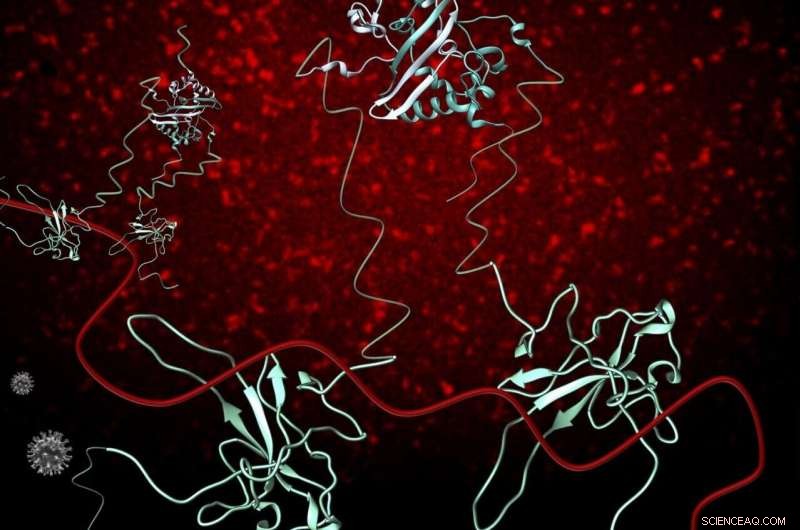
Nukleokapsidfosfoproteinet (blått) av SARS-CoV-2 (N) (grå) spelar avgörande roller i flera processer i SARS-CoV-2-infektionscykeln, inklusive replikering och transkription, och förpackning och skydd av genomiskt RNA (gRNA) (röd). N-proteinet existerar som en dimer i lösning och interagerar med gRNA övervägande genom dess strukturerade N-terminala domän. N binder RNA multivalent och när fler N-proteiner blir tillgängliga, stabiliserande interaktioner mellan RNA och proteiner inträffar, vilket resulterar i en organiserad nukleokapsid. Fluorescensavbildning av 1-1000 RNA med en Cy3 fluorescerande tagg visar att RNA-Cy3 med tillägg av FL-N, blir organiserad och förtätad (röd puncta-bakgrund). Kredit:OSU College of Science
Forskare vid Oregon State University College of Science har tagit ett viktigt steg mot nya läkemedel och vacciner för att bekämpa COVID-19 med en djupdykning i ett proteins interaktioner med SARS-CoV-2 genetiskt material.
Virusets nukleokapsidprotein, eller N-protein, är ett främsta mål för sjukdomsbekämpande interventioner på grund av de kritiska jobb som det utför för det nya coronavirusets infektionscykel och eftersom det muterar i en jämförelsevis långsam takt. Läkemedel och vacciner byggda kring N-proteinets arbete har potentialen att vara mycket effektiva och under längre tidsperioder, dvs. mindre mottaglig för motstånd.
Bland SARS-CoV-2-proteinerna, N-proteinet är det virala RNA:ts största partner. RNA:t har de genetiska instruktioner som viruset använder för att få levande celler, som mänskliga celler, att göra mer av sig själv, och N-proteinet binder till RNA:t och skyddar det.
Publicerad i Biofysisk tidskrift , fynden är en viktig startpunkt för ytterligare studier av N-proteinet och dess interaktioner med RNA som en del av en grundlig titt på mekanismerna för SARS-CoV-2-infektion, överföring och kontroll.
Elisar Barbar, professor i biokemi och biofysik vid Oregon State, och Ph.D. kandidaten Heather Masson-Forsythe ledde studien med hjälp av studenterna Joaquin Rodriguez och Seth Pinckney. Forskarna använde en rad biofysiska tekniker som mäter förändringar i storleken och formen på N-proteinet när det binds till ett fragment av genomiskt RNA-1, 000 nukleotider av de 30, 000-nukleotidgenom.
"Genomet är ganska stort för ett virus och kräver många kopior av N-proteinet för att fästa vid RNA:t för att ge viruset den sfäriska form som krävs för att viruset ska kunna göra fler kopior av sig själv, ", sade Barbar. "Vår studie hjälper oss att kvantifiera hur många kopior av N som behövs och hur nära de är varandra när de håller sig till RNA:t. "
Biofysiska studier av N med stora segment av RNA genom kärnmagnetisk resonans är sällsynta, Barbar sa, på grund av svårigheten att förbereda det delvis störda N-proteinet och långa RNA-segment, både benägna till aggregering och nedbrytning, men den här typen av studier är en specialitet i Barbar-labbet. Andra forskares studier har generellt varit begränsade till mycket mindre bitar av RNA och mindre bitar av N-proteinet.
Istället för att bara titta på de RNA-bindande regionerna i N-proteinet på egen hand, den 1, 000-nukleotidvy gjorde det möjligt för forskare att lära sig att proteinet binder mycket starkare när det är en fullängdsdimer - två kopior fästa vid varandra - och att identifiera regioner av proteinet som är väsentliga för RNA-bindning.
"Det fullständiga proteinet har strukturerade delar men är faktiskt väldigt flexibelt, så vi vet att denna flexibilitet är viktig för RNA-bindning, ", sa Masson-Forsythe. "Vi vet också att när N-proteiner börjar binda till längre RNA, resultatet är en mångsidig samling av bundna protein/RNA-komplex i motsats till ett sätt att binda."
Läkemedel som omintetgör N-proteinets flexibilitet skulle därför vara en potentiell väg för läkemedelsforskare, Hon sa. En annan möjlighet skulle vara läkemedel som stör något av de protein/RNA-komplex som visar sig vara av särskild betydelse.