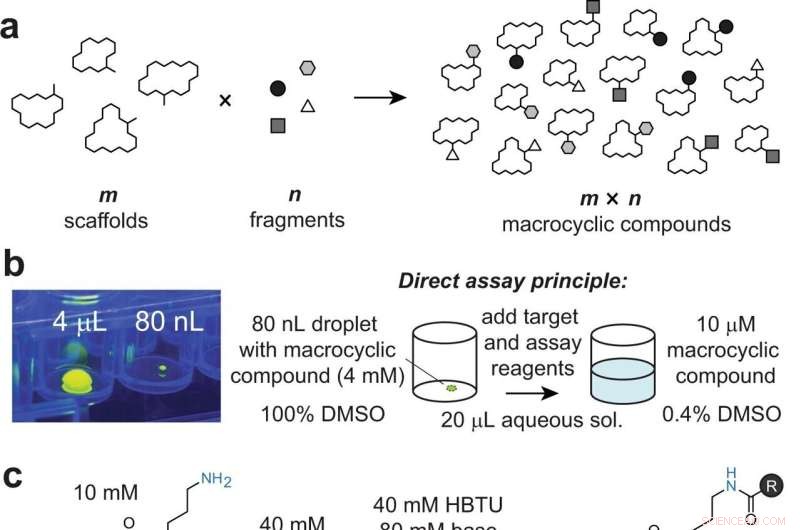
Diversifiering av makrocykliska byggnadsställningar genom att kombinatoriskt lägga till fragment till perifera grupper. en Allmän princip för tillvägagångssättet. b Bild av en 80 nL droppe överförd av ADE, visad i en 96-brunnars platta och bredvid en 4 μL droppe för skala. Dropparna innehåller fluorescein för visualisering med UV-ljus. Tillsats av mål- och analysreagens till 80 nL makrocykelreaktioner späder ut det organiska lösningsmedlet till 0,4 %, vilket är kompatibelt med bioanalyser. c Modellera makrocykelställning 1 som innehåller en perifer primär amin (blå) som är modifierad genom acylering. d Reaktion av modell makrocykel 1 med indikerade syror 1–8, kvantifierad med HPLC (absorbans och/eller jontal). Den första siffran indikerar konvertering vid 4 µL volym via pipettering med DIPEA. Den andra och tredje siffran indikerar omvandling vid 80 nL via akustisk vätskeöverföring med DIPEA respektive DABCO. e Slumpmässigt utvalda icke-peptidställningar som innehåller mindre tillgängliga aminogrupper (i blått). Kredit:Nature Communications (2022). DOI:10.1038/s41467-022-31428-8
Forskare vid EPFL har hittat ett sätt att syntetisera ett stort antal makrocykliska föreningar, som behövs för att utveckla läkemedel mot svåra sjukdomsmål.
När läkemedelsföretag börjar leta efter en läkemedelskandidat använder de en filtreringsprocess som kallas "high-throughput screening". Här testas ett stort antal olika kemiska föreningar för att se vilka som kommer att binda till ett protein som är målet för den sjukdom de vill ta itu med.
Läkemedelsföretag har faktiskt bibliotek med 1-2 miljoner "småmolekylära" föreningar som samlats in under åren. Men i många fall kan screening av klassiska småmolekylära föreningar inte identifiera läkemedelskandidater bara för att de inte innehåller en förening som binder tillräckligt starkt till målet.
En lösning har hittats i "makrocyklerna", en framväxande klass av molekyler som har visat sig vara idealiska för att binda svåra mål som proteiner med plana ytor eller till och med proteiner bundna till andra proteiner. Problemet är att nuvarande makrocykelbibliotek bara innehåller mindre än 10 000 föreningar, vilket begränsar chansen att hitta läkemedelskandidater som kan binda ett visst sjukdomsmål.
Men en grupp kemister vid EPFL har nu hittat ett sätt att generera ett stort antal makrocykler, vilket avsevärt kan öka storleken på tillgängliga bibliotek. Genombrottet, publicerat i Nature Communications , är arbetet av professor Christian Heinis grupp vid EPFL:s School of Basic Sciences.
"Vårt tillvägagångssätt bygger på att kombinera ett stort antal 'm' av olika makrocykliska byggnadsställningar med en myriad av 'n' kemiska fragment för att generera 'm×n' olika makrocykliska föreningar", säger Heinis. "Till exempel genererade vi ett bibliotek med 19 968 makrocykler genom att reagera 192 makrocykelställningar med 104 karboxylsyrafragment."
Med hjälp av EPFL:s Biomolecular Screening Facility utförde forskarna reaktionerna i små volymer på 40 nanoliter och genom att överföra reagenserna med hjälp av akustiska vågor, vilket är enormt snabbt. Genom miniatyriseringen och den höga hastigheten sattes biblioteket med 19 968 makrocykliska föreningar samman på bara en halv dag.
För att testa metoden har doktorsexamen. Student som leder projektet, Sevan Habeshian, använde det för att utveckla nanomolära hämmare mot trombin och MDM2:p53-protein-proteininteraktionen, som är läkemedelsmål för stroke och cancer.
I samarbete med forskare från universiteten i Padova och Venedig fick teamet en röntgenstruktur av trombinhämmaren medan den band proteinet. "Den strukturella analysen validerade metoden att screena föreningar som innehåller makrocykliska kärnor och lateralt kopplade kemiska fragment", säger Habeshian.
"Vi tillämpar för närvarande metoden för att utveckla makrocykliska föreningar på en rad sjukdomsmål för vilka läkemedelsföretag kämpar för att generera läkemedel baserade på klassiska små molekyler", säger Heinis. "Med tanke på den lilla storleken och den begränsade polära ytan hos makrocykliska föreningar har de en stor chans att passera genom cellmembran, vilket innebär att de kan användas för att utveckla läkemedel för intracellulära mål eller till och med läkemedel som tas oralt." + Utforska vidare