Kredit:Yoshiko Nakagawa et al, Nature Chemical Biology (2022). DOI:10.1038/s41589-021-00951-y
I ett fynd som har viktiga konsekvenser för neurodegenerativa sjukdomar som Alzheimers sjukdom, har RIKEN-forskare upptäckt hur tre chaperonemolekyler i jästceller samverkar för att bryta upp beta-arkrika fibrillära proteinaggregat som kallas amyloidfibriller.
Proteiner som är vikta på fel sätt kan inte göra sitt jobb ordentligt. Vissa felveckade proteiner som kallas prioner är särskilt lömska eftersom de överför sina förvrängda former till proteinerna runt dem, som sedan maskar ihop för att bilda robusta flottar som kallas amyloidfibriller. Amyloidfibriller har varit inblandade i prionsjukdomar (som Creutzfeldt-Jakobs sjukdom), som alltid är dödliga, och neurodegenerativa sjukdomar som Alzheimers och Parkinsons sjukdomar.
Processen genom vilken amyloidfibriller bildas har fått mycket uppmärksamhet, men mycket mindre är känt om mekanismen genom vilken de bryts upp i celler. Denna uppdelningsprocess är viktig eftersom fragmenten den producerar kan tillåta prioner att spridas mellan celler.
"Många forskare har undersökt bildningsmekanismen för amyloidfibriller, men det har gjorts väldigt få studier av amyloiduppdelning", säger Motomasa Tanaka från RIKEN Center for Brain Science. "Men de små proteinfragmenten fungerar som frön för bildning av amyloidfibriller på andra ställen, och tidigare arbete av oss tyder på att amyloiddisaggregation faktiskt är viktigare än amyloidfibrillertillväxt."
Att veta hur amyloidfibriller bryts kan också hjälpa forskare att utveckla behandlingar för prion- och neurodegenerativa sjukdomar.
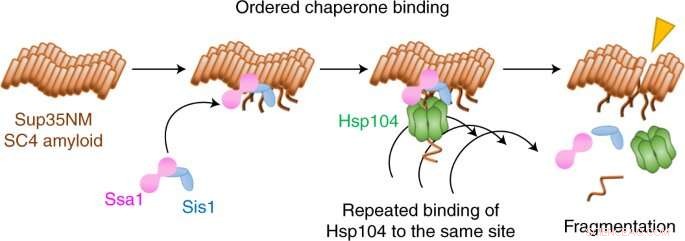
Nu har Yoshiko Nakagawa, Tanaka och medarbetare använt en form av enkelmolekylär fluorescensmikroskopi för att filma hur tre molekyler samordnar sig för att bryta upp amyloidfibriller i ett prionsystem i jäst.
De fann att uppbrottet börjar med att två chaperoner, Hsp70 och Hsp40, förbereder marken genom att binda till fibrillen. En tredje följeslagare, Hsp104, flisar sedan bort fibrillen genom att upprepade gånger binda till samma ställe.
Intressant nog fann teamet att förutom denna fragmenteringsmekanism bryter en upplösningsmekanism också upp fibriller men genom en helt annan chaperon-koreografi. Vilken mekanism som uppstår beror på fibrillens molekylära form, eller bekräftelse.
Det fanns många överraskningar i den här studien, konstaterar Tanaka. "Vi förväntade oss inte att Hsp104 fäster till samma plats så många gånger för att fragmentera amyloidfibriller", säger han. "Och uppdelningssätten för de två olika fibrillbekräftelserna är mycket olika:fragmenteringsmekanismen producerade många små fragment, medan amyloidfiberfluorescensen gradvis försvann för upplösningsmekanismen."
Teamet har för avsikt att utforska mekanismerna mer i detalj, och i framtiden hoppas de uppnå atomupplösning. + Utforska vidare