Figur 1:Vikningsprocessen för en glukostransportör med magnetisk pincett. En hög kraft appliceras först för att varva upp proteinet helt. Den applicerade kraften sänks sedan vilket gör att vikningsprocessen kan observeras. På bilden kan en del av glukostransportören ses viks för att bilda en struktur och gå in i bicellen (färgad blå). Denna vikningsprocess sker inte ofta utan extern hjälp, så denna process åstadkoms med hjälp av den omgivande membranmiljön och proteinkomplex som EMC. Kredit:Seoul National University
Celler är uppdelade av membran, och proteiner som finns i dessa membran spelar en viktig roll för att transportera cellulär information. För att dessa proteiner ska fungera korrekt måste en tertiär proteinstruktur bildas genom den korrekta veckningsprocessen. I en studie publicerad i Nature Chemical Biology , vikningsprocessen av en glukostransportör - ett komplext membranprotein - identifierades för första gången med en magnetisk pincett med en molekyl.
Med hjälp av det endoplasmatiska retikulum (ER) membranproteinkomplexet (EMC) och en lipidmolekyl med en specifik struktur, klargjordes veckningsvägen för en glukostransportör helt i en fysiologisk miljö. Genom bioinformatik upptäcktes också att membranproteinets strukturbildande förmåga och dess förmåga att transportera glukos måste ha uppnått en balans genom hela dess evolutionära historia.
Även om strukturerna hos många membranproteiner - inklusive glukostransportörer - redan har avslöjats genom de senaste framstegen inom strukturbiologin som kryoelektronmikroskopi, är den vikningsväg där strukturerna hos dessa membranproteiner bildas nästan helt okänd. Redan 2019 rapporterade forskargruppen i Science att veckningsvägarna för membranproteiner kan avslöjas med hjälp av magnetisk pincett, vilket markerar första gången i världen som veckningsvägen för ett membranprotein avslöjades.
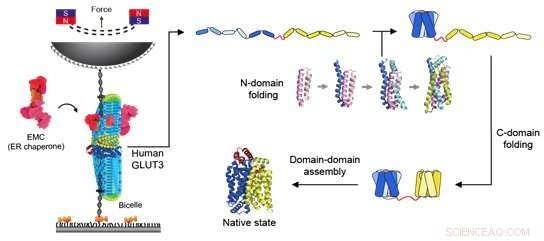
Figur 2:Schematiskt diagram av magnetisk pincett och vikningsvägen för en glukostransportör. Den vänstra visar appliceringen av kraft på glukostransportören med hjälp av magnetisk pincett. Biceller sammansatta av olika lipidmolekyler tillfördes för att tillhandahålla en miljö som krävs för att membranproteiner ska fungera. Dessutom tillsattes EMC för att hjälpa till att bilda den korrekta tertiära proteinstrukturen. När den magnetiska pärlan dras mot permanentmagneten appliceras spänning på DNA-strängen som är ansluten till proteinet, och en konstant kraft appliceras på själva proteinet. Genom detta experiment avslöjades veckningsvägen för glukostransportören som visas på höger sida av figuren. I det helt ovikta tillståndet för individuella helixproteiner viks först N-domänen nära N-terminalen för att erhålla proteinets strukturbildande förmåga. Sedan, med hjälp av EMC och en unikt formad lipidmolekyl, vikas C-domänen och slutligen kombineras de två domänerna för att bilda en funktionell tertiär proteinstruktur. Kredit:Seoul National University
Magnetisk pincett kan användas för att applicera kraft på ett enstaka protein och därigenom helt veckla ut ett proteins struktur. Dessutom, om den applicerade kraften sedan sänks, är det möjligt att observera processen där det frigjorda proteinet återveckas tillbaka till sin ursprungliga vikta form (Figur 1,2).
Glukostransportproteiner, som namnet antyder, är en grupp proteiner som har en väg genom vilken glukos kan passera. Glukostransportvägar är funktionellt väsentliga, men dessa vägar fungerar också som hinder för att bilda tertiära strukturer av membranproteiner. Celler har olika hjälpare för att lösa dessa svårigheter. I den här studien fann man att EMC – en typ av proteinchaperon – såväl som unikt strukturerade lipidmolekyler arbetar tillsammans för att hjälpa glukostransportören i dess strukturbildning.
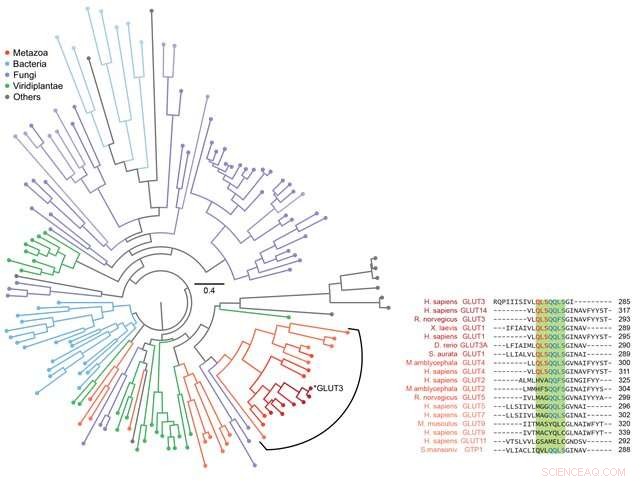
Figur 3:Fylogenetisk analys för olika sockertransportörer. Bioinformatik användes för att analysera sekvensen av GLUT3 såväl som andra evolutionärt relaterade sockertransportproteiner. Totalt 143 proteiner analyserades och presenterades som ett fylogenetiskt träd som visas i figuren till vänster. Sekvensen för sockertransportproteinet hos metazoer inklusive Homo sapiens analyserades noggrant som visas till höger. Genom att kombinera dessa data med informationen som observerats på vikningsvägen som erhålls genom magnetisk pincett, avslöjades att den strukturbildande förmågan hos membranproteiner och deras förmåga att effektivt transportera socker båda utvecklades genom en evolutionär balans. Kredit:Seoul National University