Ett ökande antal bakterier har blivit resistenta mot många vanliga antibiotika. Forskare från Bochum har upptäckt en ny möjlighet för en potentiell aktiv molekyl vars föregångare avvisades. Genom att studera dess interaktion med det bakteriella målproteinet mycket exakt i tre dimensioner, identifierade de en tidigare oupptäckt attackpunkt som kunde vara måltavla av denna förening.
"Eftersom denna attackpunkt endast förekommer i bakterieproteiner, skulle läkemedlet bli mycket mer selektivt och dess skadlighet för mänskliga celler skulle minska", förklarar professor Raphael Stoll, chef för forskningsgruppen Biomolecular NMR Spectroscopy vid fakulteten för kemi och biokemi. vid Ruhr University Bochum, Tyskland.
Forskarna publicerade sina resultat den 4 april 2024 i Journal of Medicinal Chemistry .
Studien fokuserade på proteinet peptiddeformylas (PDF). PDF är inblandat i proteinmognadsprocesser i celler och är avgörande för bakteriers överlevnad. Men det finns i både bakterier och mänskliga celler. "För cirka 20 år sedan gjordes betydande försök att bekämpa PDF med antibiotika," påpekar Stoll.
"Ändå måste den ursprungliga läkemedelskandidaten, aktinonin, kasseras av flera skäl. Ett av problemen var den nyupptäckta mänskliga PDF-filen, som potentiellt var förknippad med biverkningar. Ändå genomfördes ytterligare forskning för att generera modifierade aktiva föreningar ", tillägger Hendrik Kirschner.
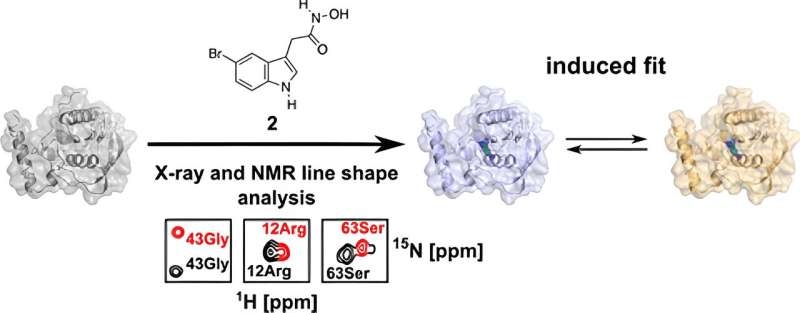
Som en del av sin doktorsavhandling undersökte han PDF i detalj i den aktuella studien och analyserade den utifrån strukturbiologins perspektiv med hjälp av biomolekylär kärnmagnetisk resonans (NMR) spektroskopi och röntgenkristallografi. Dessa tekniker gjorde det möjligt för honom att få en 3D-struktur löst i minsta detalj.
"Detta är resultatet av många års samarbete med vår kollega professor Eckhard Hofmann," säger Stoll.
"Vi kan använda dessa tekniker för att visualisera ytor och bindningsfickor av biomolekyler och visa att bindningen av molekyler till detta protein inte är statisk, utan dynamisk," förklarar Kirschner.
Forskarna noterade att det finns två olika bindningsorienteringar i proteinet för en modifierad läkemedelsmolekyl:Förutom orienteringen som också finns i mänsklig PDF, finns det ytterligare en som i princip uteslutande bör förekomma i bakteriell PDF.
"Detta uppmanar oss att modifiera läkemedelsmolekylen så att den gynnar den andra bindningsorienteringen", säger Stoll.
Som ett resultat kan den antibiotiska molekylen göras mer selektiv. "Det kan ge denna läkemedelskandidat en andra chans", avslutar Kirschner.
Mer information: Hendrik Kirschner et al, Toward More Selective Antibiotic Inhibitors:A Structural View of the Complexed Binding Pocket of E. coli Peptide Deformylase, Journal of Medicinal Chemistry (2024). DOI:10.1021/acs.jmedchem.3c02382
Journalinformation: Journal of Medicinal Chemistry
Tillhandahålls av Ruhr-Universitaet-Bochum