I de flesta industriella kemiska reaktioner kombineras katalysatorer med utgångsmaterialen och åtföljer dem genom mellanstadier till produkten. Inom kemin är denna väg känd som reaktionsmekanismen, och den är en sorts svart låda:ingen vet först vad som händer på molekylär nivå.
Om reaktionsresultatet i laboratoriet inte lever upp till förväntningarna, tillgriper kemister först försök och misstag. Enkelt uttryckt ändrar de reaktionen tills den fungerar. Ibland är det dock värt att titta närmare på reaktionsmekanismen, vilket Dr Nora Jannsen vid Leibniz Institute for Catalysis i Rostock visar med hjälp av en modellreaktion.
Hon publicerade nyligen sina resultat, som hon fick som en del av sin doktorsexamen, i Journal of the American Chemical Society .
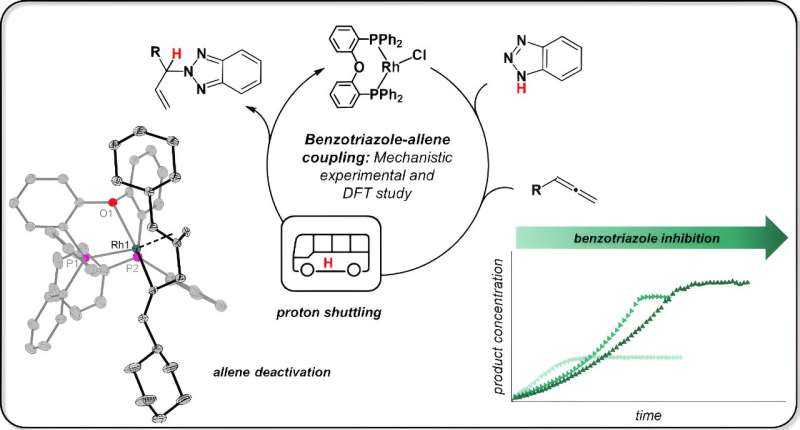
Modellreaktionen låter ospektakulär och framför allt märklig i lekmannens öra, förklarar Jannsen. "Bensotriazol, vanligtvis en korrosionsinhibitor, omvandlas till en ny substans med en allen (tyngdpunkten här ligger på andra stavelsen) med hjälp av en rodiumkatalysator." Detta kallas då allylbensotriazol och kan användas i en mängd olika synteser. Reaktionen utvecklades av en forskargrupp ledd av prof. Breit vid universitetet i Freiburg.
Kollegorna i Freiburg lyckades just koppla en "funktionell grupp" till en mycket specifik position inom bensotrizol. Det är här en kväve-vätebindning (N–H) finns, som Jannsen förklarar.
"Funktionella grupper" är viktiga som molekylära segment eftersom de är ansvariga för den specifika, t.ex. farmaceutiska, effekten.
"Freiburg-teamet ville placera en sådan grupp i bensotriazol exakt där N–H-bindningen är, och N–H-bindningen måste ge vika för detta", fortsätter Jannsen. Det lyckades kollegorna med. "Men de förstod inte på vilken grund de hade uppnått detta."
Det är synd. För endast med en förståelse för de molekylära händelserna kan reaktionen specifikt tillämpas och optimeras i framtiden. Detta var syftet med Jannsens avhandling, som hon framgångsrikt disputerade i Rostock 2023.
Så hur fungerar en sådan reaktion? Starten och slutet är kända. Vad man också vet om denna reaktion är att varje enskild atom från utgångsmaterialen senare återfinns i produkten; kemister kallar detta en "atom-ekonomisk" reaktion. Detta innebär att under reaktionens gång måste vätet från N–H-bindningen passera från bensotriazolen till det andra utgångsmaterialet, allenen.
Jannsen säger, "Freiburg-forskarna trodde att katalysatorn bryter kväve-vätebindningen, det vill säga att en så kallad oxidativ tillsats av bensotriazolen äger rum. Rodiumkatalysatorer är kända för denna typ av reaktion."
Jannsen testade idén genom att först reagera rodiumkatalysatorn med endast ett utgångsmaterial, bensotriazol. Hon isolerade prover från denna reaktion för kärnmagnetisk resonansspektroskopi (NMR) och röntgenkristallstrukturanalys. Resultatet:"N–H-bindningen bryts inte alls. Bensotriazolen förblir helt intakt, den fäster sig bara på katalysatorn."
Kemisten upptäckte då att den andra utgångssubstansen, allen, också binder till katalysatorn. Och det är här följande händer:"De två utgångsmaterialen kommer i direkt kontakt med varandra, och bensotriazolen överför väteatomen, även känd som protonen, till allenen. Katalysatorn håller bara utgångsmaterialen på plats, men ingriper inte direkt i detta steg."
Jannsen underbyggde sedan detta förslag i detalj med hjälp av kvantmekanik, d.v.s. genom att teoretiskt modellera reaktionsvägen.
Jannsen var förvånad över att katalysatorn klarade det hela så enkelt. För lekmän låter det kanske lite som ett kemiskt reptrick. I tekniska termer är en sådan process välkänd och kallas protonering.
Denna process hade en fördel. Jannsen säger, "Intressant nog kan reaktionsförhållandena för protonering förbättras avsevärt genom att lägga till ytterligare en protonkälla." Till exempel lyckades hon sänka reaktionstemperaturen från 80°C till rumstemperatur genom att tillsätta en typ av samkatalysator.
Jannsen upptäckte också att bensotriazolen även kan blockera katalysatorn under vissa omständigheter. Detta är fallet när denna utgångssubstans upptar katalysatorn två gånger, så att dess reaktionspartner, allen, inte kan hitta ett fritt utrymme på katalysatorn.
Detta förlamar den katalytiska aktiviteten och leder till att katalysatorn "konsumeras". "Det hjälper förmodligen här att helt enkelt lägga till utgångsmaterialet till reaktionen successivt så att katalysatorn kommer i mindre kontakt med den", säger Jannsen.
Mer information: Nora Jannsen et al, The Mechanism of Rh(I)-Catalyzed Coupling of Benzotriazoles and Allenes Revisited:Substrate Inhibition, Proton Shuttling, and the Role of Cationic vs Neutral Species, Journal of the American Chemical Society (2024). DOI:10.1021/jacs.4c02679
Journalinformation: Tidskrift för American Chemical Society
Tillhandahålls av Leibniz Institute for Catalysis