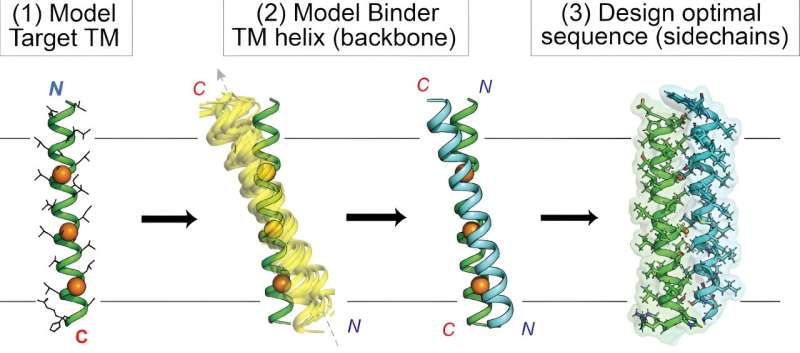
Att träffa mål inbäddade i cellmembranet har länge varit svårt för läkemedelsutvecklare på grund av membranets utmanande biokemiska egenskaper. Nu har kemister från Scripps Research visat nya specialdesignade proteiner som effektivt kan nå dessa "intramembran"-mål.
I sin studie publicerades "De Novo Transmembrane Proteins Designed to Bind and Inhibit a Cytokine Receptor" i Nature Chemical Biology , använde forskarna ett unikt datorbaserat tillvägagångssätt för att designa nya proteiner som riktade in sig på den membranspännande regionen av erytropoietinreceptorn (EPO), som styr produktionen av röda blodkroppar och kan gå snett i cancer. Utöver dessa nya EPO-inriktade molekyler, gav studien en allmän beräkningsprocess, eller "arbetsflöde", för att effektivisera den flexibla anpassade designen av proteiner riktade mot intramembranmål.
Forskarna använder nu sitt tillvägagångssätt för att utveckla potentiella nya intramembraninriktade behandlingar för ett brett spektrum av sjukdomar.
"Detta arbete öppnar upp för många nya möjligheter för modulering av mål i cellmembranet, inklusive för terapeutiska tillämpningar och förståelse av signalmekanismer över cellbiologi", säger studiens medkorrespondentförfattare Marco Mravic, Ph.D., en biträdande professor i Institutionen för integrativ strukturell och beräkningsbiologi vid Scripps Research.
Studiens andra motsvarande författare var Daniel DiMaio, MD, Ph.D., från Yale School of Medicine; och William DeGrado, Ph.D., från University of California, San Francisco School of Pharmacy, där Mravic tidigare var Ph.D. student.
"Ett huvudmål med syntetisk biologi är att designa proteiner med biologisk aktivitet - här rapporterar vi design och testning av ett litet protein som specifikt stör aktiviteten hos en mycket större proteinreceptor som är involverad i blodcellstillväxt och differentiering", säger DiMaio, som är professor i genetik och i molekylär biofysik och biokemi, och biträdande chef för Yale Cancer Center.
"Vi åstadkom detta genom att rikta in oss på segmentet av receptorn som korsar cellmembranet. Eftersom många cellproteiner innehåller strukturellt konserverade membranomspännande segment, kan detta allmänna tillvägagångssätt vara tillämpbart på många andra proteinmål och ger ett nytt verktyg för att modulera beteendet hos celler."
Att träffa intramembranmål har länge varit ett viktigt mål inom biomedicin eftersom många proteiner i celler - särskilt receptorproteiner - har funktionellt viktiga domäner inuti membranet. Sådana proteiner har framträdande roller inom nästan alla områden av hälsa och sjukdomar.
Ändå är intramembranmål inte vanliga mål. Cellmembran är i allmänhet gjorda av två lager av tätt åtskilda, fettrelaterade "lipid"-molekyler, som är vattenavvisande och har andra unika och komplexa egenskaper. Detta gör intramembranutrymmet till ett mycket svårare mål för läkemedelsdesigners, jämfört med de vattniga zonerna på cellytor eller interiörer.
"Det har varit väldigt få framgångsrika exempel på läkemedel som riktar sig mot detta utrymme inuti membranet", säger Mravic.
Dessa få framgångar, som inkluderar behandlingar för sjukdomar med låga blodplättar och cystisk fibros, har kommit från blindscreeningar av stora substansbibliotek eller från nära efterlikning av proteiner som är kända för att interagera med partnerproteiner i cellmembranet.
Däremot siktar Mravic och kollegor på att designa helt nya proteiner - små som kallas peptider - för att träffa intramembranproteinmål på nya och olika sätt. För att göra det var de tvungna att utvidga gränsen för beräkningsmetoder, genom att kombinera "datautvinning" av kända protein-till-protein-interaktioner i membran med traditionella fysikbaserade förutsägelser av proteininteraktioner.
I slutändan designade Mravic och hans kollegor de första proteinerna som binder EPO-receptorns membranomspännande del på ett nytt sätt - inte sett i naturen. Teamet visade att dessa proteiner mycket specifikt och potent blockerar receptorns funktion, i motsats till tidigare tillvägagångssätt.
Resultaten kan vara av mest omedelbart intresse för forskare som söker nya sätt att hämma EPO-receptorn, som ofta onormalt aktiveras av tumörceller för att bibehålla deras tillväxt och överlevnad. Men för Mravic och hans kollegor representerar studien framför allt ett principbevis på ett nytt och mer flexibelt tillvägagångssätt för intramembranmålinriktning.
"Vi avser att använda detta tillvägagångssätt för att rikta membranproteiner över flera biologiska processer och sjukdomsområden, inklusive cancer, immunsjukdomar och smärta," säger Mravic.
Han förväntar sig också att det beräkningsmässiga arbetsflödet som han designade för projektet kommer att vara en allmän accelerator för membraninriktad läkemedelsdesign.
"Förut innebar processen i princip att två personer i ett mörkt rum tittade på en datorskärm och sa:'Ja, jag tycker att det här ser bättre ut än så'", säger Mravic. "Nu har vi automatiserat mycket av den där molekyldesignprocessen och beslutsfattandet i datorn. Genom att vara mer modulär, flexibel och strömlinjeformad blir metoden mer tillgänglig för ett bredare spektrum av forskare."
Mravic och hans kollegor har lagt ut sina beräkningsverktyg för allmänt bruk på Github.
Mer information: De Novo Transmembrane Proteins Designade för att binda och hämma en cytokinreceptor, Naturkemisk biologi (2024). DOI:10.1038/s41589-024-01562-z , www.nature.com/articles/s41589-024-01562-z
Tillhandahålls av The Scripps Research Institute