Helikaser är enzymer som varvar DNA och RNA. De är centrala för cellulärt liv, inblandade i ett antal cancerformer och infektioner – och tyvärr utomordentligt svåra att rikta in sig på med droger.
Nu ger ny forskning en kraftfull plattform för att designa kovalenta inhibitorer skräddarsydda för målhelikaser. Uppsatsen, publicerad i Journal of the American Chemical Society , beskriver hur forskare använde denna innovativa nya plattform för att designa molekyler som tar sikte på helikaser involverade i covid och vissa cancerformer.
"Högupplösta strukturella och biokemiska data ensamma är inte tillräckliga för att hitta drogerbara platser i konformationsdynamiska enzymer som helikaser", säger Rockefeller Universitys Tarun Kapoor. "Vårt tillvägagångssätt kan identifiera dessa platser och även ge kemiska utgångspunkter för att utveckla läkemedel som riktar sig mot helikaser."
Komplexa molekylära maskiner som korsar DNA- och RNA-strängar, helikaser måste kickstarta upplösningsprocessen som förbereder genetisk information för processer som replikering eller transkription. Men när helikaser blir oseriösa kan de främja tillväxten av vissa cancerformer. Samtidigt är helikaser också avgörande för viral replikation och bakteriell spridning. Det följer att olika läkemedel som riktar sig mot dessa enzymer kan behandla vissa cancerformer eller stoppa infektioner i deras spår.
"Helikaser är väldigt heta mål just nu", säger huvudförfattaren Jared Ramsey, en doktorand i Kapoor-labbet. "Droger som hämmar helikaser är av stort intresse för forskarvärlden och skulle kunna utnyttjas som nya och effektiva behandlingar."
Helikashämmare är dock svåra att få tag på. Genom att testa tusentals små molekyler har läkemedelsföretag då och då råkat ut för metoder för att stoppa en eller annan helikas, men dessa händelser har visat sig sällsynta. "Detsamma gällde i vårt labb," säger Ramsey. "Vi kunde inte identifiera helikashämmare med typiska metoder som screening med hög genomströmning."
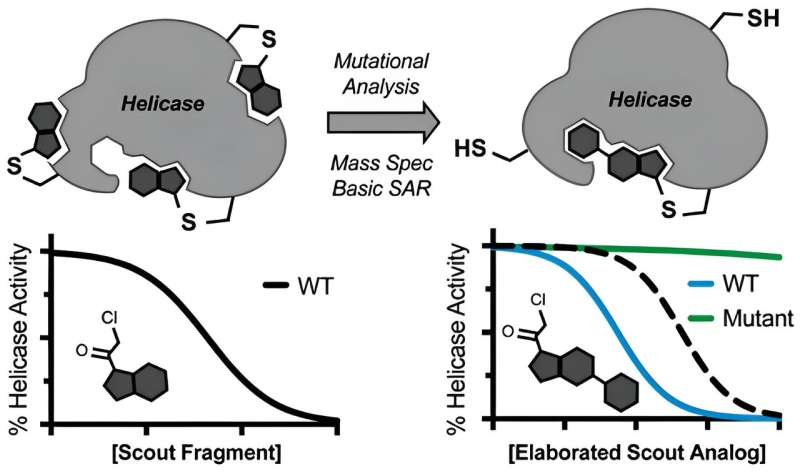
Ramsey, Kapoor och kollegor undrade om elektrofila små molekyler kunde användas för att spana ut de svaga punkterna i en helikas, och tyst driva enzymet för potentiella bindningsställen som är mottagliga för droger.
Centralt för denna idé är begreppet kovalens, där inhibitorkandidater irreversibelt binder helikasmålet, vilket möjligen kringgår komplikationer från dessa enzymers dynamiska och flytande natur. För det ändamålet valde teamet två ofarliga molekyler och riktade de så kallade scoutfragmenten mot en helikas av SARS-CoV-2.
När de hittade troliga bindningsställen på helikasen, främjade de scouterna till soldater. "Vi var bara tvungna att ta en minimalt utvecklad elektrofil molekyl, identifiera var den binder med masspektrometri och sedan använda medicinsk kemi för att modifiera den och screena några versioner av för att uppnå en potent, specifik hämmare," säger Ramsey.
Teamet visade också att scoutfragment kunde ställas in för att stänga av två specifika helikaser, BLM och WRN, som är inblandade i Blooms syndrom respektive Werners syndrom, såväl som ett antal cancerformer. Även om de publicerade resultaten inte förväntas omedelbart översättas till läkemedel som behandlar covid eller cancer, fungerar de som en värdefull utgångspunkt för läkemedelsutvecklare att göra skräddarsydda helikasmål.
"Våra resultat visar hur plattformen vi utvecklade kunde påskynda arbetet i andra labb," säger Ramsey. "Vi använder ett grundläggande vetenskapligt tillvägagångssätt, och det är så många användbara rön som avslöjas. Detta kräver ett utmanande problem och ger oss en solid plats att börja."
Mer information: Jared R. Ramsey et al, Using a Function-First "Scout Fragment"-Based Approach to Developing Allosteric Covalent Inhibitors of Conformationally Dynamic Helicase Mechanoenzymes, Journal of the American Chemical Society (2023). DOI:10.1021/jacs.3c10581
Tillhandahålls av Rockefeller University