Forskare från Boston College använde en mild laddning av elektricitet för att exakt modifiera proteiner, ett nytt verktyg som kan användas för att utveckla nya bioterapeutiska och proteinbaserade forskningsverktyg, rapporterade laget nyligen i tidskriften Nature Chemistry .
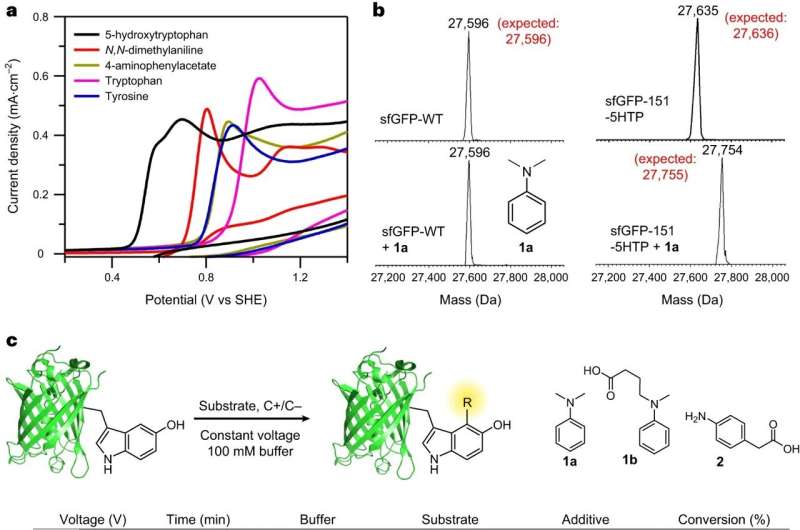
Teamet, ledd av BC-professorerna i kemi Abhishek Chatterjee och Eranthie Weerapana, utvecklade och optimerade en ny elektrokemisk proteinmärkningsreaktion kallad "eCLIC" som möjliggör exakt modifiering av platsspecifikt inkorporerade 5-hydroxitryptofan (5HTP)-rester på många olika proteiner inklusive full -längd terapeutiska antikroppar.
"Vi använde den här strategin för att generera många platsspecifika proteinkonjugat, inklusive ett antikropps-cytotoxiskt läkemedelskonjugat som selektivt kommer in i och dödar cancerceller, men inte icke-cancerceller", säger Chatterjee. "En viktig fördel med eCLIC är att reagenserna som behövs för den här metoden är riktigt billiga och kostar mindre än 10 USD per gram."
Teamets framgång markerade första gången elektrokatalys har använts för att uppnå proteinmodifiering på ett platsspecifikt sätt, rapporterade de i sin artikel "Elektrokemisk märkning av hydroxiindoler med kemoselektivitet för platsspecifik proteinbiokonjugation."
Proteiner är stora molekyler, vanligtvis sammansatta av hundratals aminosyramonomerer, noterade Chatterjee. Förmågan att selektivt modifiera proteiner på fördefinierade platser är viktig för många tillämpningar. Till exempel, genom att kovalent binda giftiga läkemedel till antikroppar har det varit möjligt att selektivt leverera dem till cancerceller, vilket resulterade i både förbättrad terapeutisk effekt och minskad toxicitet utanför målet.
Många forskningsapplikationer kräver också att biofysikaliska prober fästs på olika proteiner. Förmågan att definiera platsen för modifiering av proteiner är avgörande för att säkerställa att viktiga proteinfunktioner inte skadas, sa Chatterjee.
"Utmaningen uppstår från det faktum att alla proteiner är gjorda av 20 aminosyror i olika kombinationer", sa han. "Att identifiera en modifierbar funktionalitet på den önskade platsen, som inte upprepas någon annanstans, är vanligtvis utmanande, vilket gör det svårt att uppnå platsspecificitet vid proteinmodifiering."
För att övervinna dessa utmaningar, försökte teamet utveckla en metod för att införliva en icke-naturlig aminosyra på valfri plats(er) av ett protein. Teamet åstadkom detta genom att omarbeta översättningssystemet för celler för att rymma den nya aminosyran 5HTP.
Dessutom ville forskarna designa kemiska reaktioner som skulle kunna användas för att selektivt modifiera denna icke-naturliga aminosyra i närvaro av alla naturliga aminosyror, sa Chatterjee.
"Om vi kunde göra detta skulle vi kunna tillhandahålla en generell metod för att generera proteiner med ett inbyggt "fästehandtag" på en fördefinierad plats. Vi var särskilt intresserade av att utveckla en reaktion som skulle använda elektricitet för att katalysera proteinmodifieringen reaktion istället för kemisk katalys eftersom den förra är billig, miljövänlig och skonsam mot känsliga proteiner."
Chatterjee sa att laget kunde övervinna en ovanlig utmaning när de först försökte modellera reaktionen. Vanligtvis börjar forskare med små molekyler, i det här fallet 5HTP och anilin, och går sedan vidare till stora proteiner.
Men de första försöken med reaktionen mellan 5HTP och aniliner på småmolekylnivå var röriga, eftersom 5HTP-molekylerna reagerade företrädesvis med varandra. Men när 5HTP införlivades i ett stort protein kunde det inte längre reagera med ett annat proteinbundet 5HTP och reagerade rent med ett anilin istället, rapporterade teamet.
"Om vi hade hållit fast vid den traditionella utvecklingen - från liten till stor - skulle vi aldrig ha följt eCLIC och tänkt "det är för rörigt", sa Chatterjee. "Istället gjorde vi vår reaktionsutveckling icke-traditionellt, direkt på ett protein, vilket hjälpte oss att inse hur rent och selektivt det var i den här miljön."
För att ytterligare främja eCLIC-strategin för storskalig modifiering av viktiga proteinmål har denna teknologi licensierats till BrickBio, Inc., som Chatterjee var med och grundade. Framtida forskning kommer att fokusera på att utveckla nästa generations, platsspecifikt modifierade proteinbaserade bioterapeutika och forskningsreagenser.
Mer information: Conor Loynd et al, Elektrokemisk märkning av hydroxiindoler med kemoselektivitet för platsspecifik proteinbiokonjugation, Nature Chemistry (2023). DOI:10.1038/s41557-023-01375-y
Tillhandahålls av Boston College