Ett team från University of Massachusetts Amherst har gjort stora framsteg mot att modellera och förstå hur intrinsically disordered proteiner (IDP) genomgår spontan fasseparation, en viktig mekanism för subcellulär organisation som ligger till grund för många biologiska funktioner och mänskliga sjukdomar.
IDP spelar avgörande roller i cancer, neurodegenerativa sjukdomar och infektionssjukdomar. De utgör ungefär en tredjedel av de proteiner som mänskliga kroppar producerar, och två tredjedelar av cancerassocierade proteiner innehåller stora, oordnade segment eller domäner. Genom att identifiera de dolda egenskaperna som är avgörande för internflyktingars funktion och självmontering kommer forskare att förstå vad som går fel med dessa funktioner när sjukdomar uppstår.
I en artikel publicerad i Journal of the American Chemical Society , seniorförfattare Jianhan Chen, professor i kemi, beskriver ett nytt sätt att simulera fasseparationer förmedlade av internflyktingar, en viktig process som har varit svår att studera och beskriva.
"Faseparation är ett riktigt välkänt fenomen inom polymerfysik, men vad folk inte visste förrän för ungefär 15 år sedan var att detta också är ett riktigt vanligt fenomen inom biologin", förklarar Chen. "Du kan titta på fasseparation med ett mikroskop, men att förstå detta fenomen på molekylär nivå är mycket svårt.
"Under de senaste fem eller tio åren har människor börjat upptäcka att många av dessa störda proteiner kan driva fasseparation, inklusive många viktiga inblandade i cancer och neurodegenerativa sjukdomar."
Den nya artikeln, baserad på forskning i Chens beräkningsbiofysik och biomateriallabb, utgör ett kapitel av huvudförfattaren Yumeng Zhangs doktorsexamen. avhandling. Zhang börjar arbeta som postdoktor vid Massachusetts Institute of Technology (MIT) i februari. En annan viktig bidragsgivare är Shanlong Li, en postdoktorand forskningsassistent i Chens labb.
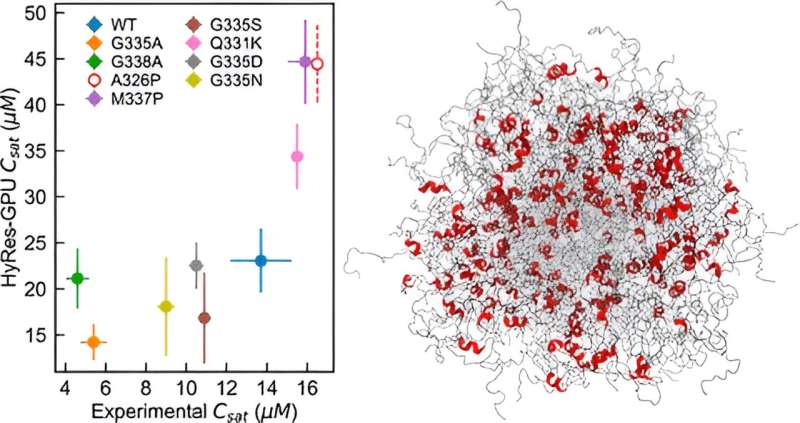
Chens labb utvecklade ett noggrant, GPU-accelererad hybridupplösning (HyRes) kraftfält för simulering av fasseparationer medierade av IDP:er. Denna modell är unik i sin förmåga att exakt beskriva peptidryggradsinteraktioner och övergående sekundära strukturer, samtidigt som den är beräkningseffektiv nog att modellera vätske-vätskefasseparation. Denna nya modell fyller ett kritiskt tomrum i den befintliga förmågan inom datorsimulering av IDP-fasseparering.
Chen och team skapade HyRes-simuleringar för att för första gången demonstrera vad som styr kondensatstabiliteten hos två viktiga internflyktingar.
"Jag hade faktiskt inte förutsett att det skulle kunna göra ett så bra jobb med att beskriva fasseparation eftersom det är ett riktigt svårt fenomen att simulera," säger Chen. "Vi visade att den här modellen är tillräckligt korrekt för att börja titta på effekterna av ens en enda mutation eller kvarvarande strukturer i fasseparationen."
Forskarnas HyRes-GPU tillhandahåller ett innovativt simuleringsverktyg för att studera de molekylära mekanismerna för fasseparation. Det slutliga målet är att utveckla terapeutiska strategier för behandling av sjukdomar associerade med störda proteiner.
"Detta är verkligen betydelsen av det här arbetet," säger Chen. "Viktiga biologiska processer tros uppstå genom fasseparation. Så om vi bättre kan förstå vad som styr denna process, kommer den kunskapen att vara riktigt kraftfull, om inte nödvändig, för att vi ska kunna tänka på att kontrollera fasseparationen för olika vetenskapliga och tekniska ändamål. Detta kommer att hjälpa oss att förstå vilken typ av intervention som kommer att krävas för att uppnå terapeutiska effekter."
Chen säger att nästa steg är att tillämpa vad hans team har lärt sig på simuleringar i större skala av mer komplexa biomolekylära blandningar.
"Shanlong arbetar nu med att konstruera en liknande modell för nukleinsyror eftersom fasseparation ofta involverar både störda proteiner och nukleinsyror", säger han. "Vi vill kunna beskriva båda nyckelkomponenterna, och det skulle tillåta oss att titta på många fler system."
Mer information: Yumeng Zhang et al, Toward Accurate Simulation of Coupling between Protein Secondary Structure and Phase Separation, Journal of the American Chemical Society (2023). DOI:10.1021/jacs.3c09195
Journalinformation: Tidskrift för American Chemical Society
Tillhandahålls av University of Massachusetts Amherst