I planetmodellen för atomstruktur består en atom av en tung, positivt laddad kärna omgiven av ett moln av mycket lättare, negativt laddade elektroner. Protoner levererar den positiva laddningen, och varje element har ett annat antal av dem. Antalet protoner i kärnan bestämmer atomens antal för ett element. Det skiljer sig från atommassa eller atomvikt, som tar hänsyn till förekomsten av neutroner. Varje atom i ett visst element har alltid samma atomantal, men atommassan kan variera beroende på antalet neutroner i kärnan.
TL; DR (för lång; läste inte)
Atomnummer är antalet protoner i kärnan i ett element. Den definierar elementets position i den periodiska tabellen. Atomvikten, som är ett annat tal som visas bredvid elementets symbol, är ett genomsnitt av atommassorna för alla elementets isotoper.
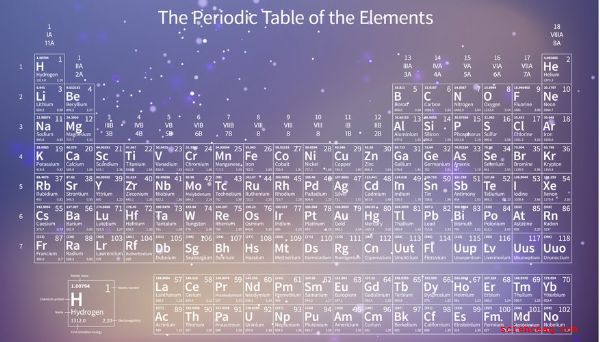
Periodic Table
Den periodiska tabellen är ett diagram som listar alla element i ordning enligt ökande atomantal. Forskare känner till 118 element. Nummer 118, oganesson (Og), som är ett konstgjordt producerat radioaktivt element, lades till 2015. Oganesson har det högsta atomnumret eftersom det har det högsta antalet protoner i sin kärna. Väte (H) har å andra sidan bara en proton i sin kärna, så dess atomnummer är 1, och det visas i början av det periodiska systemet. Atomnumret för varje element, som är antalet protoner i dess kärna, visas bredvid dess symbol i tabellen. Om atomnumret inte var där, kan du fortfarande säga hur många protoner som fanns i kärnan hos ett givet element genom att räkna antalet platser mellan det elementet och väte.
Atomic Number Is Not Atomic Mass or Atomic
Om du letar upp ett element i den periodiska tabellen ser du ett annat nummer bredvid dess atomnummer. Detta är elementets atomvikt, och det är vanligtvis två gånger atomantalet eller mer. Atomvikten är inte densamma som atommassan.
Atommassan i en atom är massan för alla protoner och neutroner i kärnan. Elektroner har så små massor jämfört med nukleoner att de anses försumbara. Atommassa uttrycks i atommasseenheter (amu) för en enda atom och i gram per mol för makroskopiska mängder. En mol är kvantifierad som Avogadros antal (6.02 × 10 23) atomer. En atom i ett visst element har alltid samma antal protoner. Om det hade ett annat nummer skulle det vara ett annat element. Atomer av samma element kan emellertid ha olika antal neutroner. Varje version kallas en isotop av det elementet, och varje isotop har en annan atommassa. Atommassan som listas i den periodiska tabellen är ett genomsnitt av atommassorna i alla de naturligt förekommande isotoperna i det elementet. Detta genomsnitt är atomvikten för det elementet.