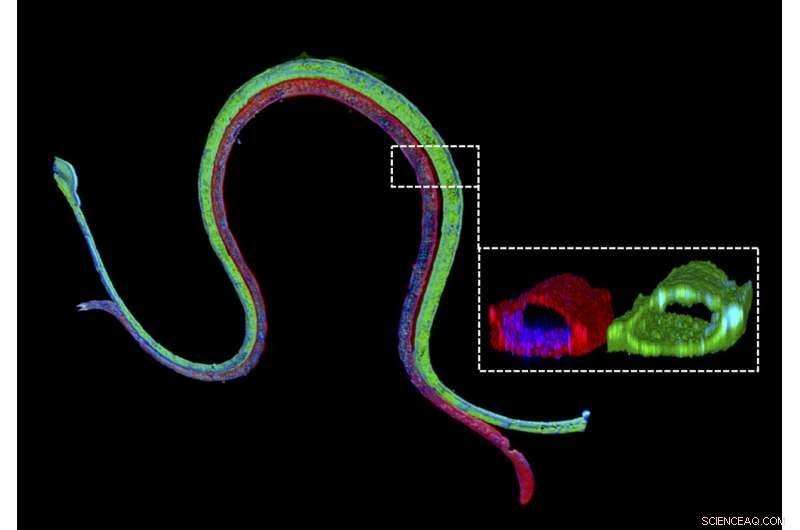
Immunofluorescensfärgning av en 3D-bioprintad vaskulariserad proximal tubuli med en proximal tubuliepitelmarkör färgad i grönt i den proximala tubulikanalen och en vaskulär endotelmarkör färgad i rött i den intilliggande vaskulära kanalen. Det förstorade tvärsnittet illustrerar att de två olika celltyperna bildar luminala perfuserbara strukturer i sina respektive kanaler. Kredit:Wyss Institute vid Harvard University
Varje dag tar våra njurar sig an den skrämmande uppgiften att kontinuerligt rengöra vårt blod för att förhindra avfall, salt och överflödig vätska från att byggas upp i våra kroppar. För att uppnå detta, njurarnas cirka en miljon filtreringsenheter (glomeruli) tar först bort både slaggprodukter och värdefulla näringsämnen från blodomloppet, sedan specialiserade strukturer som kallas proximala tubuli reabsorberar de "goda" molekylerna och återför dem till vårt blodomlopp. Medan de reabsorptiva funktionerna i den proximala tubuli kan äventyras av läkemedel, kemikalier, eller genetiska och blodburna sjukdomar, vår förståelse för hur dessa effekter uppstår är fortfarande begränsad.
För att möjliggöra studiet av njurreabsorption utanför människokroppen, Wyss Institute Core Faculty-medlem Jennifer Lewis, Sc.D., och hennes team som arbetar inom Wyss Institutes 3-D Organ Engineering Initiative som hon tillsammans leder, och i samarbete med Roche Innovation Centre Basel i Schweiz, skapat en 3D-vaskulariserad proximal tubulimodell där oberoende perfuserbara tubuli och blodkärl trycks intill varandra i en konstruerad extracellulär matris. Detta arbete bygger på en kontinuerligt perfunderad 3-D proximal tubulimodell som rapporterats tidigare av teamet som fortfarande saknade ett funktionellt blodkärlsutrymme. Med deras nästa generations enhet, teamet har mätt transporten av glukos från den proximala tubuli till blodkärlen, tillsammans med effekterna av hyperglykemi, ett tillstånd i samband med diabetes hos patienter. Deras studie publiceras i Proceedings of the National Academy of Sciences ( PNAS ).
Lewis är också Hansjörg Wyss professor i biologiskt inspirerad teknik vid Harvard John A. Paulson School of Engineering and Applied Science (SEAS), Jianmin Yu professor i konst och vetenskap och medlem av Harvard Stem Cell Institute.
"Vi konstruerar dessa levande njuranordningar på några dagar och de kan förbli stabila och funktionella i månader, " sa förstaförfattaren Neil Lin, Ph.D., som är Roche Fellow och postdoktor i Lewis team. "Viktigt, dessa 3D-vaskulariserade proximala tubuli uppvisar de önskade epitel- och endotelcellsmorfologierna och luminala arkitekturerna, såväl som uttryck och korrekt lokalisering av nyckelstruktur- och transportproteiner, och faktorer som gör att de tubulära och vaskulära avdelningarna kan kommunicera med varandra."
Som ett första steg mot att testa läkemedel och modellera sjukdomar, laget inducerade "hyperglykemi", ett högt glukostillstånd som är typiskt för diabetes och en känd riskfaktor för kärlsjukdom, i deras modell genom att cirkulera en fyra gånger högre än normal glukoskoncentration genom det proximala tubulifacket. "Vi fann att höga nivåer av glukos som transporteras till endotelceller i kärlutrymmet orsakade cellskador, sa Kimberly Homan, Ph.D., en medförfattare på studien och Research Associate i Lewis grupp vid Wyss Institute och SEAS. "Genom att cirkulera ett läkemedel genom tubuli som specifikt hämmar en viktig glukostransportör i proximala tubuli epitelceller, vi förhindrade dessa skadliga förändringar från att hända med endotelcellerna i de intilliggande kärlen."
Teamets omedelbara fokus är att ytterligare skala upp dessa modeller för användning i farmaceutiska tillämpningar. "Vårt system kan möjliggöra screening av fokuserade läkemedelsbibliotek för njurtoxicitet och därmed bidra till att minska djurförsök, sa Annie Moisan, Ph.D., en medförfattare och branschsamarbetspartner i studien, och huvudforskare vid Roche Innovation Center Basel. "Jag är stolt över de fortsatta ansträngningarna från oss och andra för att öka den fysiologiska relevansen av sådana modeller, till exempel genom att inkorporera patientspecifika och sjuka celler, eftersom personlig effekt och säkerhet är de yttersta målen för att förutsäga kliniska svar på läkemedel."
"Vår nya 3D-njurmodell är ett spännande framsteg eftersom den mer fullständigt rekapitulerar de proximala tubulisegmenten som finns i inhemsk njurvävnad, ", sa Lewis. "Utöver dess omedelbara tillämpningar för läkemedelsscreening och sjukdomsmodellering, vi undersöker också om dessa levande enheter kan användas för att förstärka njurdialys." livräddande dialysmaskiner filtrerar blod, men de kan inte hämta värdefulla näringsämnen och andra arter från filtratet som kroppen behöver för många av sina funktioner, vilket kan orsaka specifika brister och komplikationer längre fram. Lewis and her colleagues believe that 3-D bioprinted vascularized tubules may lead to improved renal replacement therapies.
"This study presents a significant step forward in human kidney engineering that enables human disease and drug-related studies to be carried out over extended periods of time in vitro. It also represents a major step forward for the Wyss Institute's 3-D Organ Engineering Initiative, which aims to generate functional organ replacements with enhanced functionalities for patients in need, " said Wyss Institute Founding Director Donald Ingber, M.D., Ph.D., who is also the Judah Folkman Professor of Vascular Biology at HMS and the Vascular Biology Program at Boston Children's Hospital, as well as Professor of Bioengineering at SEAS.