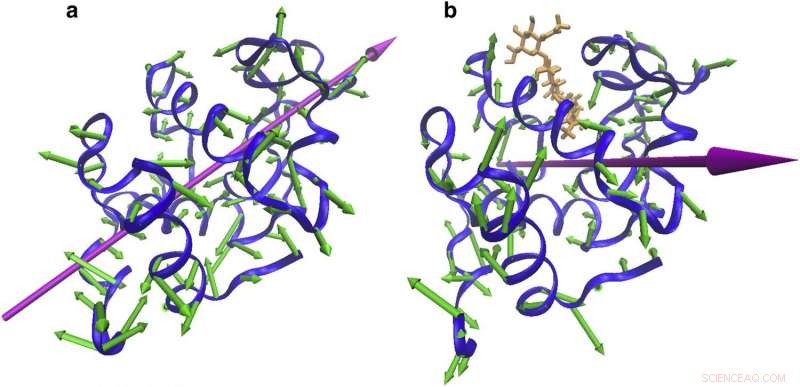
Förändringar i vibrationsriktning med bindning. Proteinvibrationer som indikerar (a) en klämrörelse runt bindningsstället vid 55 cm1 från NMA från fri CEWL och (b) en vridning runt bindningsstället. Kredit:Omtryckt med tillstånd av Biophysical Journal.
I varje ögonblick i människokroppen, en noggrant koreograferad dans utförs.
Proteiner skakar kroppen och viftar med lemmarna, alla med målet att optimera deras interaktion med andra molekyler, inklusive andra proteiner. Dessa små rörelser, kallas vibrationer, gör det möjligt för molekylerna att snabbt ändra form för att binda till varandra, vilket i sin tur underlättar uppgifter som att absorbera syre och reparera celler.
Kroppens effektivitet för att utföra dessa funktioner beror på hur väl proteiner kan interagera.
Men vad gör ett protein till en bättre friare än ett annat?
En ny studie belyser denna fråga, visar att i denna biologiska uppvaktning, dansrörelser spelar roll.
"Förr, forskning om proteinvibrationer fokuserade mycket på energin i dessa vibrationer, säger huvudforskaren Andrea Markelz, Doktorsexamen, en professor i fysik vid universitetet vid Buffalo College of Arts and Sciences. "Men det vi fann är att rörelseriktningen verkar ha större betydelse. Rörelseriktningen - riktningen i vilken olika delar av proteinet rör sig - kan verkligen avgöra hur väl ett protein utför sin biologiska funktion."
Resultaten hjälper till att lägga en grund för utvecklingen av läkemedel som riktar sig mot molekylära vibrationer. Sådana läkemedel skulle blockera proteiner från att utföra uppgifter som bidrar till sjukdom.
"Vi genomförde forskningen med hjälp av en ny teknik som vi utvecklat som kallas anisotropisk terahertzmikroskopi (ATM), som avslöjar hur naturen utnyttjar proteinrörelser för att förbättra effektiviteten. Vi kan sedan optimera dessa rörelser för medicin och bioteknik, "säger författaren Katherine Niessen, en UB -doktorand i fysik.
Forskningen, publicerad den 14 mars i Biofysisk tidskrift , genomfördes av UB, universitetet i Perugia i Italien, och Hauptman-Woodward Medical Research Institute. Det finansierades av National Science Foundation (NSF).
Foxtrot eller tango?
Studien fokuserade på kycklingäggvita lysozym, ett protein som finns i äggvitor.
Som ett första steg i deras projekt, forskarna jämförde lysozymets regelbundna vibrationer med lysozymets vibrationer när det var bundet till en molekyl vars närvaro blockerade proteinet från att utföra sina vanliga biologiska uppgifter.
Vad forskarna såg var att de fria och inhiberade lysozymerna vibrerade vid liknande energier, men med distinkta rörelseriktningar:Det fria lysozymet fladdrade med en gångjärnsliknande klappverkan-som en fjärils vingar-medan det inhiberade lysozymet rörde sig i ett mer saxliknande mönster.
"Resultatet var en grundläggande förändring från den konventionella synvinkeln. Vibrationerna ändrade deras riktning, även om rörelsernas energi förblev densamma, "Säger Markelz. (Hon tillägger att som en analogi, detta liknar två personer som utför olika danser - foxtrot och tango, till exempel - men utövar samma mängd energi.)
Samma dynamik uppstod när laget jämförde det vanliga lysozymet med ett mutant kycklingäggvita lysozym som var mer effektivt för att utföra sitt jobb. De mutanta och normala lysozymerna hade samma vibrationsenergier, men olika vibrationsriktningar.
Ett nyckelfärdigt instrument för att mäta vibrationer
Forskning om molekylära vibrationer kan öppna nya vägar för läkemedelsutveckling och konstgjord energihörning (vibrationerna kan förklara varför fotosyntesen är så effektiv). Men historiskt sett de små pulserna och hjärtklappningarna inom proteiner har varit mycket svåra att studera.
Markelz hoppas kunna ändra det genom att utveckla ett nyckelfärdigt instrument som forskare runt om i världen kan använda för att undersöka vibrationerna.
För att studera kycklingäggets vita lysozym, hennes team använde ATM-tekniken som hennes forskargrupp utvecklade internt. Till skillnad från andra metoder som används för att undersöka proteinvibrationer, ATM gör det möjligt för forskare att observera inte bara vibrationsenergier, men också rörelseriktningen.
NSF tilldelade Markelz nyligen nästan $ 400, 000 bidrag för att kommersialisera ett lättanvänt ATM-instrument, vilket skulle utöka det vetenskapliga samfundets förmåga att utforska molekylära vibrationer. Enheten skulle representera ett stort framsteg jämfört med andra befintliga metoder, som endast ger en grov överblick över vibrationerna och kräver extremt torra och kalla miljöer och dyra anläggningar, Säger Markelz.