
Fig. 1. Schematisk illustration av en påse innesluten i ett trezonsmembran, bildas när en droppe HA i lösning faller i en PA-lösning. Det innersta lagret (1) är en gel av HA-molekyler. Den är omgiven av ett lager av nanofibrer som ligger tangentiellt på säckens yta (2), ur vilka nanofibrer kommer ut vinkelrätt (3).
Tekniker för att skapa komplexa nanostrukturerade material genom självmontering av molekyler har blivit allt mer sofistikerade. Men att föra dessa tekniker till det biologiska området har varit problematiskt. Nyligen, forskare från Northwestern University använde självmontering under kontrollerade förhållanden för att skapa ett membran bestående av lager med distinkt olika strukturer. Nu, arbetar vid U.S. Department of Energy's Advanced Photon Source (APS), teamet använde småvinklar röntgenspridning (SAXS) för att bättre bestämma dessa strukturer och studera hur de bildas. Denna nya information banar väg för design och syntes av hierarkiska strukturer med biomedicinska tillämpningar.
Peptidamfifiler (PA) är kedjor av aminosyror som är spetsade med andra molekyler så att ena änden är hydrofil (blandar väl med vatten) och den andra hydrofob (inte förtjust i vatten). I vattenlösning, PA är långa, tunna nanofibrer eftersom aminosyrakedjorna binder till intilliggande kedjor för att bilda β–ark. Forskarna vid Northwestern University hade tidigare funnit att när en vattenlösning innehållande positivt laddade PAs kom i kontakt med en vattenlösning av negativt laddad hyaluronsyra (HA - en stor biologisk molekyl som förekommer i bindväv och andra vävnader), en tät, fibröst lager som bildas inom millisekunder, skapa en barriär som hindrade de två lösningarna från att blandas.
Mer exakt, forskarna fann att det fibrösa lagret hindrar aggregerade PA från att migrera till HA-sidan, men tillåter HA-molekyler att långsamt insinuera sig själva genom barriären till PA-sidan, på en tidsskala av minuter eller längre.
Resultatet blev en membranstruktur med tre zoner:ett gelliknande skikt på HA-sidan, en fibermatta bestående av PA-nanofibrer som ligger i gränsytan mellan lösningarna, och en beläggning av fibrer riktade vinkelrätt bort från gränsytan och bildade av elektrostatiskt bundna komplex av PA och HA (Fig. 1).
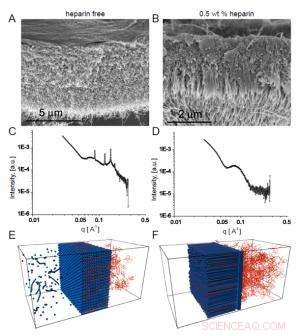
Fig. 2. Svepelektronmikrofotografier visar det homogena membranet som bildas i frånvaro av heparin (A), medan det i närvaro av heparin bildas en fibrös struktur tvärs membranet (B).
Teamets intresse för dessa membran hängde på möjliga biomedicinska användningar där peptidsekvensen som bildar nanofibrerna skulle ha en vald biologisk aktivitet. I ett exempel, de inkorporerade en heparinbindande sekvens för att främja angiogenes (bildningen av nya blodkärl), så att membranet kan hjälpa till med vävnadsreparation. För att strukturen med tre zoner ska bildas, forskarna fann att HA-lösningen måste innehålla heparin i ett visst koncentrationsområde. Svepelektronmikroskopi visade tydligt linjär struktur som korsade membranet som bildades när heparin var närvarande vid 0,5 viktprocent (fig. 2a), i motsats till det mer homogena utseendet av membranet skapat i frånvaro av heparin (fig. 2b).
Forskarna vände sig till SAXS vid DuPont-Northwestern-Dow Collaborative Access Team beamline 5-ID-D vid Argonne APS, en Office of Science-användaranläggning. Dessa studier ger insikt i den exakta strukturen hos trezonsmembranen och en bättre förståelse för dynamiken i deras bildande.
De heparinfria membranen producerade väldefinierade Bragg-toppar, medan trezonsmembranen inte gjorde det. Dessutom, membran som uppstod i närvaro av mindre heparinkoncentrationer visade större Bragg-toppar än de som producerades när heparinkoncentrationen var högre, vilket indikerar en konkurrens mellan två strukturer vars resultat berodde på heparinnivåer.
En tidsserie av SAXS-mätningar på ett heparinfritt experiment visade att Bragg-topparna började bildas några minuter efter att de två lösningarna kom i kontakt, och nådde full styrka efter ca 45 minuter.
Att tolka SAXS-fynden i ljuset av deras tidigare experiment och de kända egenskaperna hos PA och HA, forskarna förklarar skillnaderna mellan de två typerna av membran som ett resultat av olika typer av aggregering. I frånvaro av heparin, PA och HA kommer samman i nanosfäriska aggregat som packas ihop i ett kubiskt arrangemang, under en period av några tiotals minuter, för att bilda ett membran som genererar väldefinierade Bragg-toppar.
När heparin är närvarande, däremot det binder starkt till PA och förändrar dess interaktion med AH-molekyler. I detta fall, en barriär av nanofibrer som ligger parallellt med lösningsgränssnittet bildas omedelbart, fungerar sedan som en diffusionsbarriär genom vilken HA långsamt passerar. När det dyker upp på andra sidan, det binder till PA för att bilda nanofibrer som växer vinkelrätt mot gränsytan. Denna beställda nanofibermatris producerar inga Bragg-toppar.
Den ökade förståelsen och kontrollen av dessa processer som härrör från denna forskning skulle kunna göra det möjligt att bygga bioaktiva membran med en mängd olika strukturer och syften.