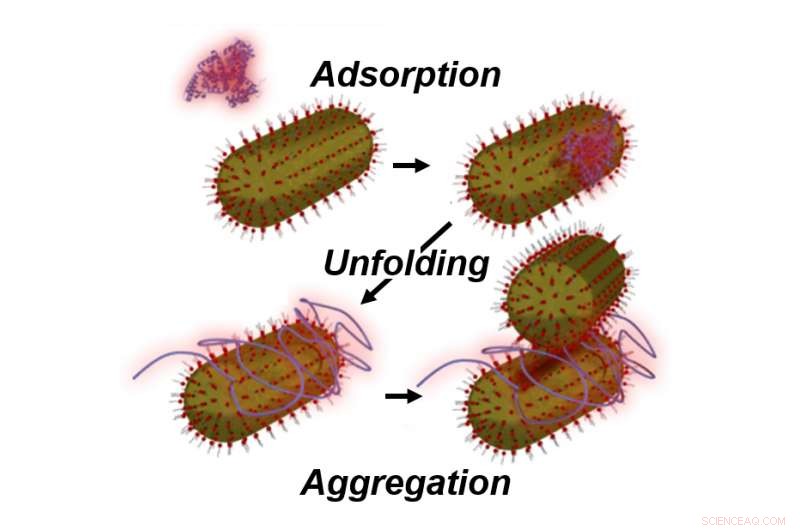
Rice University forskare observerade nanopartikelaggregation inducerad av låga koncentrationer av oveckade serumalbuminproteiner. De tror att proteinerna vecklas ut när de binds till guldnanopartiklar och förhindrar att andra proteiner sammanfogar dem för att bilda ett skyddande hölje runt partikeln. Kredit:Rice University
Blodserumproteiner har observerats kombinera en-till-en med guldnanopartiklar och få dem att aggregera, forskare vid Rice University rapporterade.
Detta är oväntat, enligt risforskarna Stephan Link och Christy Landes, som har lett studier av de proteiner som är mest ansvariga för att hålla fasta ämnen i blodet separerade. I låga koncentrationer, de sa, proteinerna fäster irreversibelt, vecklas ut och sedan sammanföra nanopartiklar.
Detta strider mot syftet med albuminproteiner, den vanligaste i blodomloppet, sa de.
Pappret, publicerades denna månad i tidskriften American Chemical Society ACS Nano , har konsekvenser för sjukdomar orsakade av aggregering, som Alzheimers, och för nanopartikeltoxicitetsproblem, sa forskarna. Guldnanopartiklar används alltmer som terapeutiska medel.
För flera år sedan fann Rice-teamet att högre koncentrationer av bovint serumalbumin (BSA), en nära match för sin mänskliga motsvarighet, skulle kunna hålla naturligt hydrofoba guldnanopartiklar från att klumpa sig. I nya experiment, vissa använder teknik som först har blivit tillgänglig på senare år, BSA-proteiner i låga koncentrationer observerades utvecklas i närvaro av guldnanopartiklar.
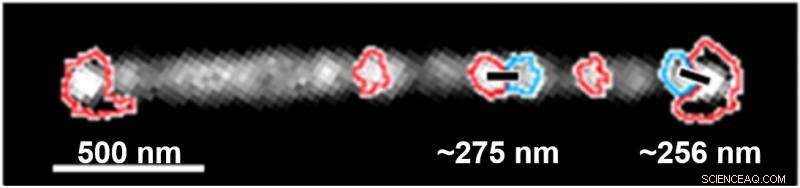
Detta är en superupplösningskarta över identifierade individuella bovina serumalbuminmolekyler, som markerats av de färgade konturerna. Nanotråden i guld, i grått och tusentals nanometer långt, visar den relativa storleken på proteinerna, som upptar områden mycket större än förväntat baserat på storleken på deras utvikta geometri. Forskarna sa att detta stöder upptäckten att det bara finns utrymme för ett protein på de mindre nanopartiklar som studerats. Kredit:Rice University
"Vi tror att proteinet fäster först och utvecklas, och som hindrar andra proteiner från att komma in, ", sa Link. "Men det underlättar också aggregeringen."
"Detta är det vanligaste proteinet i blodserum, Landes sa. "Dess uppgift är att omge och göra ett fint hårt skal runt allt i lösning som annars skulle vara olösligt och stabilisera den komplicerade blandningen av celler, proteiner och hormoner i blodet.
"Det som är viktigt är proteinets förmåga att framgångsrikt belägga annars hydrofoba steroidhormoner, nanopartiklar, virus, något, " sa hon. "Men för att det ska göra den där beläggningen, den måste hålla sig snyggt vikt."
Genom att veckla ut sig i närvaro av guldnanopartiklar, de sa, proteinet gör två saker:det sprider sig på partikeln, lämnar inget utrymme för andra proteiner att fästa, och avslöjar dess vanligtvis dolda hydrofoba kärna, vilket uppmuntrar aggregering med andra protein-nanopartikeluppsättningar.
"Detta är en fråga om människor använder nanopartiklar för terapeutiska ändamål eller bara kommer i kontakt med nanopartiklar i produkter eller miljön, ", sa Landes. "Om serumalbumin kan göra sitt jobb, allt är bra. Men vi kan inte låta bli att lägga märke till att protein utvecklas, proteinaggregation och fibrillerbildning är roten till alla möjliga sjukdomar."
Medan deras tidigare forskning visade att albuminproteiner i höga koncentrationer håller nanopartiklar lösliga, "det finns biologiska situationer där koncentrationen av serumalbuminprotein kan vara tillräckligt låg för att orsaka problem, " sa Landes.
De noterade också att två andra blodburna proteiner, fibrinogen och globulin, orsaka guldnanopartiklar att aggregera oavsett deras koncentrationer. "De utvecklas oavsett koncentration, vilket betyder att BSA eller humant serumalbumin verkligen är designade för att göra denna beläggning och hålla allt från att ta slut, " sa Link.
"Vi säger att folk verkligen måste vara uppmärksamma på förhållandet mellan proteinet - i det här fallet, BSA – och nanopartiklar, för olika saker kan hända."