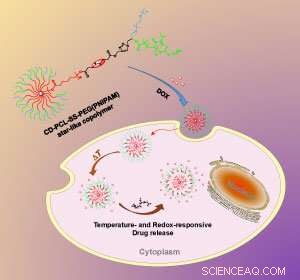
Förändringen i temperatur och kemisk miljö inuti cellen triggar nanopartikeln att frigöra sin läkemedelsnyttolast. Kredit:Royal Society of Chemistry
A*STAR-forskare har utvecklat läkemedelsleveranspartiklar i nanoskala som kan känna av sin omgivning, och släpper sin nyttolast först efter att ha gått in i en cell, en upptäckt som skulle kunna göra många befintliga läkemedel mer effektiva.
De nya nanopartiklarna, utvecklad av Zibiao Li från A*STAR Institute of Materials Research and Engineering och hans medarbetare, är en betydande uppgradering från tidigare generationer av polymerbaserade nanopartiklar för läkemedelsleverans. Tidiga exempel bestod vanligtvis av enkla polymerkedjor med en polär, hydrofilt huvud och en opolär, hydrofob svans. I vatten, dessa kedjor aggregerar naturligt till sfärer, med sina hydrofoba svansar som alla pekar inåt för att bilda en icke-polär kärna. Kärnan bildade en bra plats för läkemedelsmolekyler att nästla sig. I blodomloppet, dock, dessa aggregat tenderar att slitas isär.
Li och hans kollegor använde de senaste polymersyntesteknikerna för att skapa enmolekylära nanopartiklar. Istället för ett självmonterat aggregat av separata polymerer, teamet syntetiserade en mer robust struktur där polymerkedjorna var starkt kovalent bundna till en central kärna. Syntesen började med beta-cyklodextrin, en cirkulär sockermolekyl med 21 hydroxylgrupper på sin yta. Hydroxylgrupperna bildade de kemiska ankare från vilka teamet konstruerade nanopartikelns flera långa, Y-formad, multifunktionella polymerarmar.
"Den största utmaningen med att göra [nanopartikeln] var att integrera olika syntetiska metoder i en makromolekylär design, " säger Li. Vid en av ändarna av varje Y-formad gren, teamet bifogade en temperaturkänslig polymer som heter PNIPAM. Vid rumstemperatur sträcker sig PNIPAM-polymeren utåt, men kollapsar när kroppstemperaturen, 37 grader Celsius, är nådd, tillåta nanopartikelns läkemedelsmolekyllast att fly.
Halvvägs längs varje polymerarm, teamet installerade en svavel-svavelbindning. När partiklarna kommer in i en cell, de möter höga nivåer av glutation, en molekyl som klyver svavel-svavelbindningar. På så sätt klipps nanopartikelns yttre polymerbeläggning av, och läkemedlet frisätts ännu snabbare.
När teamet testade denna effekt med ett läkemedel mot cancer som heter doxorubicin, dubbelverkande effekten var tydlig. "Förändringen från rumstemperatur till kroppstemperatur, och effekten av glutation, visade synergistisk och snabb frisättning av läkemedlet, " säger Li. Vid lägre temperaturer, eller i frånvaro av glutation, läkemedelsfrisättningen var betydligt långsammare, han säger.
"Nästa plan är att integrera ny funktionalitet, för precisionsfrisättning av läkemedlet för riktad cancerterapi, " säger Li. Ena änden av varje Y-formad gren skulle kunna funktionaliseras med en molekyl som fastnar selektivt till cancerceller, leverera läkemedlet precis där det behövs.