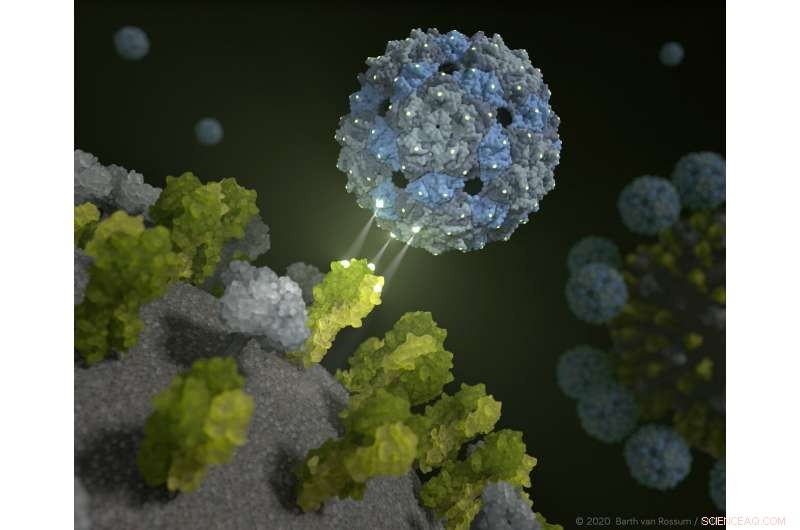
Fagskal dockar och hämmar influensaviruset. Kredit:Barth van Rossum / FMP
Ett nytt tillvägagångssätt ger hopp om nya terapeutiska alternativ för att dämpa säsongsinfluensa och fågelinfluensa. På basis av ett tomt och därför icke-infektiöst skal av ett fagvirus, forskare från Berlin har utvecklat en kemiskt modifierad fagkapsid som kväver influensavirus.
Perfekt passande bindningsställen gör att influensavirus omsluts av fagkapsiderna på ett sådant sätt att det är praktiskt taget omöjligt för dem att infektera lungceller. Detta fenomen har bevisats i prekliniska prövningar med mänsklig lungvävnad. Forskare från Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP), Freie Universität Berlin, Technische Universität Berlin (TU), Humboldt-Universität (HU), Robert Koch Institute (RKI) och Charité-Universitätsmedizin Berlin rapporterar att resultaten också används för den omedelbara utredningen av coronaviruset. Fynden har nu publicerats i Naturens nanoteknik .
Influensavirus är fortfarande mycket farliga. Världshälsoorganisationen (WHO) uppskattar att influensa är ansvarig för upp till 650, 000 dödsfall per år över hela världen. Nuvarande antivirala läkemedel är endast delvis effektiva eftersom de angriper influensaviruset efter att lungceller har infekterats. Det skulle vara önskvärt – och mycket mer effektivt – att förhindra infektion i första hand.
Det är precis vad det nya tillvägagångssättet från Berlin lovar. Fagkapsiden, utvecklad av ett tvärvetenskapligt team av forskare, omsluter influensavirus så perfekt att de inte längre kan infektera celler. "Prekliniska prövningar visar att vi kan oskadliggöra både säsongsbetonade influensavirus och fågelinfluensavirus med vårt kemiskt modifierade fagskal, " förklarade professor Dr Christian Hackenberger, Institutionschef för kemisk biologi vid Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) och Leibniz Humboldt professor i kemisk biologi vid HU Berlin. "Det är en stor framgång som erbjuder helt nya perspektiv för utvecklingen av innovativa antivirala läkemedel."
Flera bindningar passar som kardborreband
Den nya inhibitorn använder sig av trivalenta receptorer på ytan av influensaviruset, kallas hemagglutininprotein, som fäster vid sockermolekyler (sialinsyror) på cellytorna i lungvävnaden. Vid infektion, virus hakar fast i deras offer – i det här fallet, lungceller — som ett kardborrefäste. Kärnprincipen är att dessa interaktioner uppstår på grund av flera bindningar, snarare än enkelbindningar.
Det var ytstrukturen hos influensavirus som inspirerade forskarna att ställa följande första fråga för mer än sex år sedan:Skulle det inte vara möjligt att utveckla en inhibitor som binder till trevärda receptorer med en perfekt passform, simulerar ytan av lungvävnadsceller?
De fann att detta verkligen är möjligt med hjälp av en ofarlig tarminvånare:Q-beta-fagen har de ideala ytegenskaperna och är utmärkt lämpad att utrusta den med ligander - i det här fallet, sockermolekyler - som "bete". Ett tomt fagskal gör jobbet perfekt. "Vår multivalenta ställningsmolekyl är inte smittsam, och omfattar 180 identiska proteiner som är fördelade exakt som de trivalenta receptorerna för hemagglutinin på virusets yta, " förklarade Dr Daniel Lauster, en före detta Ph.D. student i Group of Molecular Biophysics (HU) och nu postdoc vid Freie Universität Berlin. "Den har därför de idealiska startförhållandena för att lura influensaviruset - eller, för att vara mer exakt, att fästa på den med en perfekt rumslig passform. Med andra ord, vi använder ett fagvirus för att inaktivera influensaviruset!"
För att göra det möjligt för Q-beta-ställningen att uppfylla önskad funktion, den måste först modifieras kemiskt. Producerad från E. coli-bakterier vid TU Berlin, Professor Hackenbergers forskargrupp vid FMP och HU Berlin använder syntetisk kemi för att fästa sockermolekyler på virusskalets definierade positioner.
Virus luras och omsluts
Flera studier med hjälp av djurmodeller och cellkulturer har visat att den på lämpligt sätt modifierade sfäriska strukturen har avsevärd bindningsstyrka och hämmande potential. Studien gjorde det också möjligt för Robert Koch Institute att undersöka den antivirala potentialen hos fagkapsider mot många nuvarande influensavirusstammar, och även mot fågelinfluensavirus. Dess terapeutiska potential har till och med bevisats på mänsklig lungvävnad, som forskarkollegor från medicinska institutionen, Avdelningen för Infektiologi och Pneumologi, av Charité kunde visa:När vävnad infekterad med influensavirus behandlades med fagkapsiden, influensavirusen kunde praktiskt taget inte längre föröka sig.
Resultaten stöds av strukturella bevis av FU-forskare från Research Center of Electron Microscopy (FZEM):Högupplöst kryoelektronmikroskopi och kryoelektronmikroskopi visar direkt och spatialt att inhibitorn helt kapslar in viruset. Dessutom, matematisk-fysikaliska modeller användes för att simulera interaktionen mellan influensavirus och fagkapsiden på datorn. "Våra datorstödda beräkningar visar att den rationellt utformade inhibitorn verkligen fäster till hemagglutinin, och helt omsluter influensaviruset, " bekräftade Dr. Susanne Liese från AG Netz vid Freie Universität Berlin. "Det var därför också möjligt att beskriva och förklara den höga bindningsstyrkan matematiskt."
Terapeutisk potential kräver ytterligare forskning
Dessa fynd måste nu följas upp av fler prekliniska studier. Det är ännu inte känt, till exempel, huruvida fagkapsiden provocerar ett immunsvar hos däggdjur. Helst detta svar kan till och med förstärka effekten av inhibitorn. Dock, det kan också vara så att ett immunsvar minskar effekten av fagkapsider vid upprepad exponering, eller att influensavirus utvecklar resistens. Och, självklart, det har ännu inte bevisats att hämmaren också är effektiv på människor.
Ändå, alliansen av Berlin-forskare är säker på att tillvägagångssättet har stor potential. "Vår rationellt utvecklade, tredimensionell, multivalent inhibitor pekar på en ny riktning i utvecklingen av strukturellt anpassningsbara influensavirusbindare. Detta är den första bedriften i sitt slag inom multivalensforskning, " betonade professor Hackenberger. Kemisten anser att detta tillvägagångssätt, som är biologiskt nedbrytbar, icke-toxisk och icke-immunogen i cellodlingsstudier, kan i princip även appliceras på andra virus, och möjligen även till bakterier. Det är uppenbart att författarna betraktar tillämpningen av sin inställning till det nuvarande coronaviruset som en av sina nya utmaningar. Tanken är att utveckla ett läkemedel som förhindrar koronavirus från att binda till värdceller som finns i halsen och efterföljande luftvägar, förhindrar därmed infektion.