Forskare vid Yale University, New Haven, har optimerat en polymerbaserad mRNA-vehikel för riktad lungtillförsel och visat potentialen hos plattformen för slemhinnevaccination mot luftvägspatogener.
I en artikel, "Polymernanopartiklar levererar mRNA till lungan för slemhinnevaccination", publicerad i Science Translational Medicine , introducerar teamet sitt skapande av inhalerbart budbärar-RNA (mRNA) för terapeutiskt bruk.
Klinisk forskning har letat efter ett effektivt och riktat sätt att leverera mRNA till lungorna för olika terapeutiska tillämpningar, inklusive proteinersättningsterapier, genredigering och vaccination. De största utmaningarna har varit att upprätthålla mRNA-stabilitet och undvika immuninterferens.
Yale-teamet skapade PACE (Polymerized Albumin Conjugates for mRNA Encapsulation) polymerformuleringar för att leverera lokalt mRNA till lungorna. Forskarna optimerade PACE-polyplex för att förbättra mRNA-skydd, transfektionseffektivitet och antigenpresentation för effektiva lungspecifika terapeutiska och vaccinationsstrategier.
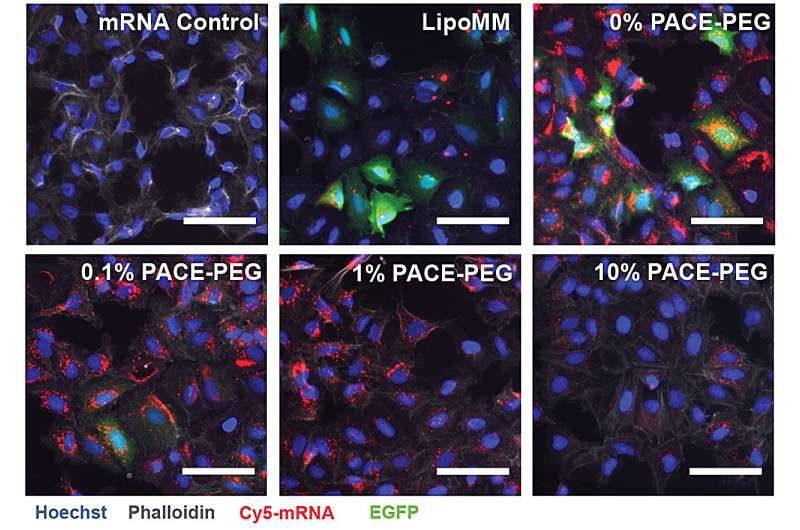
För att stabilisera PACE, integrerades ett optimerat förhållande av polyetylenglykol (PEG) molekyler i polymerstrukturen under den enzymatiska sampolymerisationsprocessen, vilket stabiliserade polyplexen och modifierade nyckelegenskaper. PEG kunde påverka storleken, ytladdningen och andra egenskaper hos polyplexen, vilket gjorde dem mer lämpade för laddning och effektiva vid mRNA-leverans till lungceller.
Den stabiliserade formuleringen fungerade dåligt i ett cellodlingsexperiment in vitro. Forskarna noterar att traditionella cellodlingsmetoder inte är bra prediktorer för leveranssystem, varken positivt eller negativt. Miljön i kroppen, särskilt lungorna, interagerar väldigt annorlunda än en samling celler. Till exempel saknas slemhinneytorna, och dessa ytor är precis vad PACE-PEG-systemet är designat för att dra nytta av. Det verkliga testet skulle komma in vivo med en musmodell.
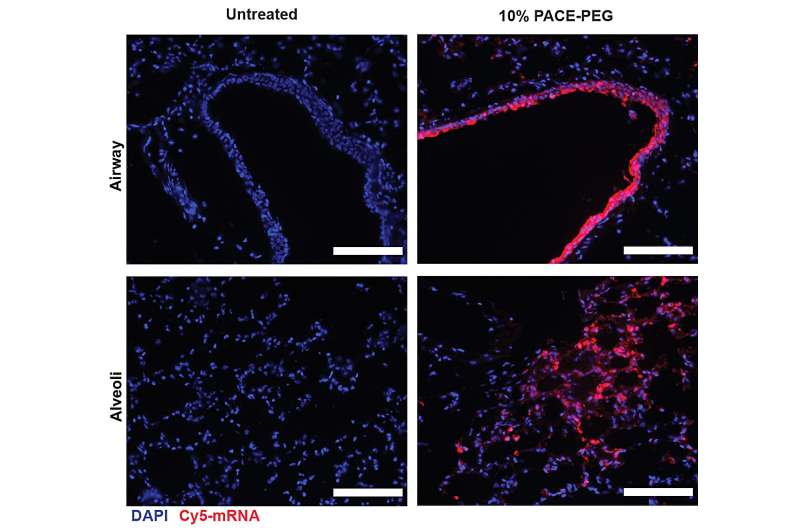
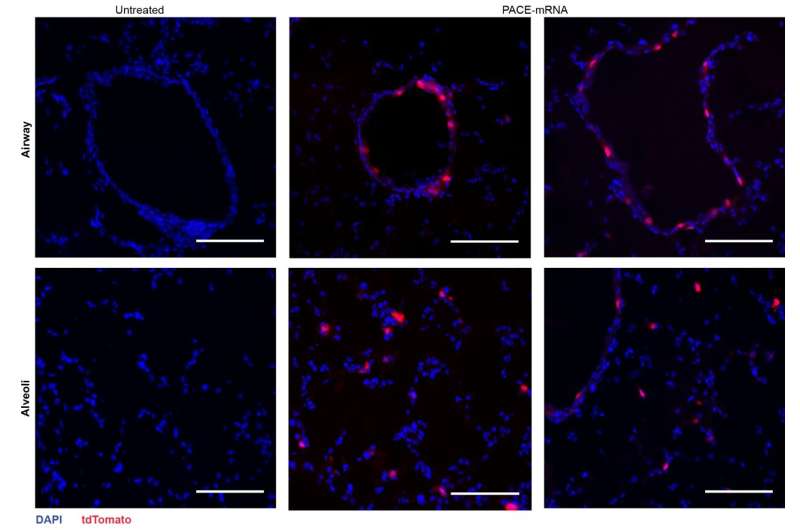
Forskarna kapslade in mRNA som kodar för spikproteinet från SARS-CoV-2 i PACE och inokulerade möss som är mottagliga för SARS-CoV-2-infektion. Möss fick en dos på 10 μg PACE-mRNA tillfört intranasalt dag 0 och 28. Utvecklingen av adaptiv immunitet i mediastinala lymfkörtlar testades och bekräftades 14 dagar efter boosten.
Efter att ha bedömt det lokala immunsvaret undersökte forskarna lungvävnader, blodserum och bronkoalveolär sköljvätska för lokala och systemiska antigenspecifika T-cells- och antikroppssvar. Transfektion inträffade främst i lungepitelceller och antigenpresenterande celler, två celltyper som är relevanta mål för lungsjukdomar
Vaccinationen ökade framgångsrikt spikproteinspecifik CD8 + T-celler i lungvävnaden och cirkulerande CD8 + T-celler i blodomloppet. CD8 + T-celler uttryckte markörer som indikerar vävnadsresident minne. Både cirkulerande och mukosala IgG-antikroppar hittades i signifikant högre koncentrationer hos vaccinerade möss.
Möss introducerades sedan till en dödlig dos av SARS-CoV-2. PACE-mRNA-vaccination minskade signifikant virusbördan i lungorna och förbättrade vikten och överlevnaden för de vaccinerade mössen. Detta skydd tillskrevs det spikproteinspecifika immunsvar som inducerades av vaccinationen.
Kontrollgruppen visade inga tecken på ett spikproteinspecifikt immunsvar och uppvisade inte minskad virusmängd eller förbättrad överlevnad efter virusutmaningen.
Studien presenterar PACE-mRNA-polyplex som en lovande metod för effektiv och riktad mRNA-leverans till lungorna med potentiella fördelar för både terapeutiskt proteinuttryck och slemhinnevaccination mot luftvägspatogener.
Studien illustrerar också vikten av djurmodeller i motsats till enbart cellkultur för att bestämma verkliga effekter. De positiva resultaten indikerar att mer forskning är berättigad, med ytterligare tester planerade på större djurmodeller.
Mer information: Alexandra Suberi et al, Polymernanopartiklar levererar mRNA till lungan för slemhinnevaccination, Science Translational Medicine (2023). DOI:10.1126/scitranslmed.abq0603
Journalinformation: Science Translational Medicine
© 2023 Science X Network