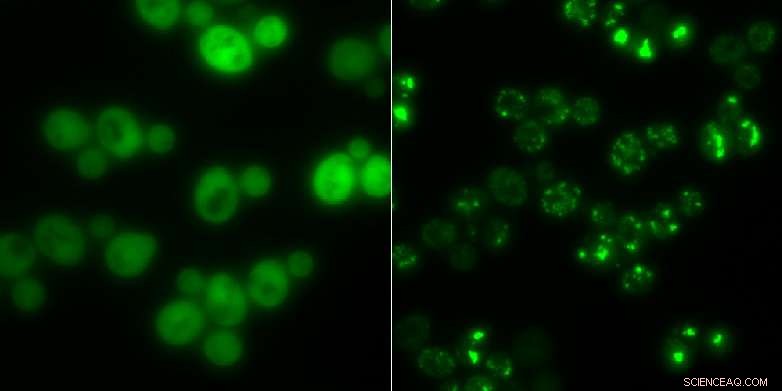
Jästceller utan proteinaggregat (till vänster) och de med (ljusa lysande fläckar):I tider av svält, klumparna fungerar som tillfällig lagring för proteiner. Kredit:Matthias Peter / ETH Zürich
Forskare vid ETH har upptäckt att bildningen av proteinaggregat i jästceller är reversibel. Detta kastar nytt ljus över mänskliga sjukdomar som kan hänföras till vissa proteinaggregat.
Proteinaggregat har ett dåligt rykte. Ett antal mänskliga sjukdomar, speciellt nervsystemet, som Alzheimers, Parkinsons, eller amyotrofisk lateralskleros (ALS), beror på att degenererade proteiner klumpar ihop sig i nervceller, skapar aggregat som cellerna inte kan lösa upp. Detta gör att cellerna dör.
Nu, forskare under ledning av ETH-professor Matthias Peter och Reinhard Dechant har kastat nytt ljus över proteinaggregat i en studie som involverar jästceller. Motsvarande artikel har precis publicerats i tidskriften Naturens cellbiologi . I det, ETH-forskarna visar att proteinklumpar bildas i jästceller som svar på stressfaktorer som näringssvält eller värme. Om cellerna överlever stressen, de kan lösa upp aggregaten igen, snabbt återvinna de enskilda komponenterna, och använda dem för cellulär metabolism.
Klumpar bildas som svar på stress
Forskarnas upptäckt av enzymet Cdc19 är ett exempel på ett protein som klumpar ihop sig under stress. Enzymet levererar energi till cellerna. Forskarna upptäckte att Cdc19 bryts ner i fyra identiska underenheter vid glukossvält. Dessa underenheter ändrar sedan sin ursprungliga form och klumpar ihop sig med andra molekyler, såsom ribonukleinsyror eller andra enzymer, att bilda aggregat. Forskarna hänvisar till dessa klumpar som stressgranulat. När det väl har införlivats i ett aggregat av detta slag, Cdc19 blir inaktiv och kan inte längre producera bränsle till cellen. Under denna tid, cellen kan varken växa eller föröka sig.
Dock, processen är reversibel. Så fort stressen har gått över, stressgranulerna löses upp, och de fyra subenheterna av Cdc19 sätts ihop så att enzymet kan återuppta sin roll i glukosmetabolismen.
Klumparna har ett tydligt syfte, säger Matthias Peter:"Jästcellen använder aggregat som ett slags lager för viktiga enzymer, så att dessa är skyddade från nedbrytning i stresssituationer och kan återaktiveras omedelbart efter att cellen överlevt stressen." han säger, skydda dessa molekyler från att brytas ned av cellens egna bortskaffande mekanismer. Om cellen var tvungen att syntetisera dessa föreningar igen efter varje stresssituation, det skulle kosta cellen mycket tid och energi.
En enkel sekvens är tillräcklig för att klumpa ihop sig
Forskarna klargjorde också hur och varför Cdc19 kan bilda klumpar. I strukturen av en Cdc19-subenhet, de identifierade en kort, ovikt underavsnitt med en enkel sammansättning. I tekniska termer, dessa sektioner är kända som "låg komplexitetsregioner" (LCR), och forskarna säger att de också förekommer i andra aggregatbildande proteiner i andra organismer, inklusive människor.
"LCR exponeras på grund av nedbrytningen av enzymkomplexet och utlöser aggregationsprocessen, ", säger Peter. "Det var därför viktigt för oss att hitta en sådan sekvens i Cdc19. Detta bekräftar att det finns en allmän mekanism." I jästens normala tillstånd, LCR för Cdc19 är dold, eller har flera fosfatgrupper som LCR "avaktiverar". Det är först vid näringsstress som LCR kommer fram och fosfatgrupperna tas bort – och först då kan aggregat bildas.
Ett viktigt fynd
"Vår forskning har skapat en känsla av ett nytt uppvaknande i forskarsamhället, säger Reinhard Dechant, en gruppledare vid Institutet för biokemi, som ledde studien tillsammans med Matthias Peter. Tills nu, han säger, aggregat sågs främst som patogena partiklar, eftersom det enda som syns hos patienter är resultatet av processen – dvs. olösliga proteinplack som orsakar en sjukdom. "Vårt dokument undersöker också början av aggregering och hur det fortskrider, säger Dechant, förklarar att proteinklumpar inte bildas bara på grund av en sjukdom, utan snarare för att cellen behöver dem för att överleva en stresssituation. "För första gången, vi kunde visa att både bildandet och nedbrytningen av aggregat är en viktig mekanism i celler."
Andra ETH Zürich forskargrupper som undersöker aggregat i jästceller har gjort liknande upptäckter tidigare. Följaktligen, andra ETH-forskare kunde visa att klumpar av degenererade proteiner fungerar, bland annat, som ett minne och hjälpa cellerna att lagra tidigare (negativa) upplevelser (som rapporterats i ETH News). Det verkar därför som om den funktionella aggregeringen av vissa proteiner är en utbredd regleringsmekanism.