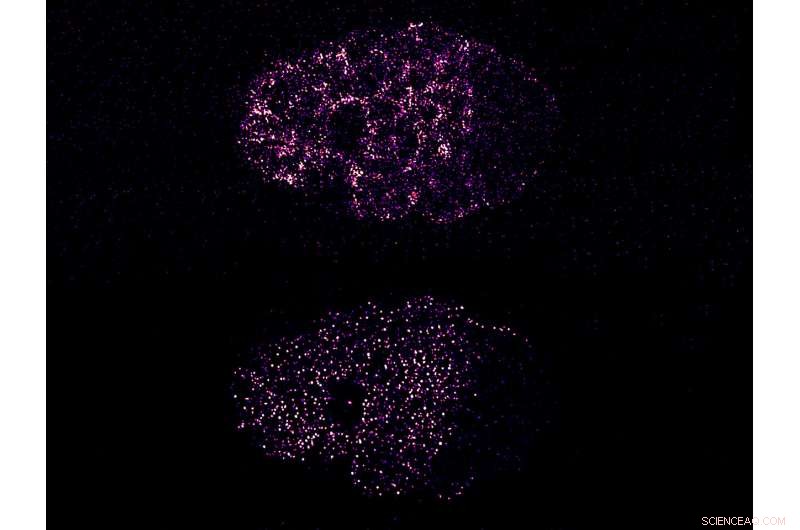
Figur:Sammandragning driver PAR-proteinklustring för att bryta symmetri i ett C. elegans-embryo. Den översta bilden visar den kontraktila aktiviteten av kortikalt myosin, vilket orsakar klustring av PAR-3-protein (nedre bilden). Både myosin och PAR-3 segregerar på vänster sida av embryot, främre polen. Detta bryter den tidigare symmetriska fördelningen av dessa proteiner och polariserar cellen. Kredit:Mechanobiology Institute, Singapore
Ett team av forskare från Mechanobiology Institute, Singapore (MBI) vid National University of Singapore, tillsammans med kollegor från Temasek Life Sciences Laboratory och A*STARs Institute of Molecular and Cell Biology i Singapore, har avslöjat en ny mekanism för att etablera cellpolaritet som är beroende av spänningskraftinducerad klustring av proteiner. Detta arbete publicerades i den vetenskapliga tidskriften Naturens cellbiologi i augusti 2017.
Kortikala krafter inducerar proteinkluster för cellpolarisering
Biologiska celler visualiseras vanligtvis som runda (eller sfäriska) i form, med en kärna centrerad i mitten, och andra cellulära komponenter utspridda överallt. I verkligheten, varje celltyp uppvisar en distinkt form, storlek och sammansättning. Avbildningar av symmetriska sfärer är, i huvudsak, en överförenkling som döljer det faktum att nästan alla celler är asymmetriska i sin sammansättning, och att denna asymmetri utvecklas i precisa och välordnade steg.
Känd som cellpolaritet, denna centrala egenskap hos celler ser separationen av de subcellulära komponenterna i distinkta regioner av cellen. Om cellerna var symmetriska, processer som delning och rörelse av celler skulle inte ske korrekt, och vävnader och organ skulle vara deformerade och icke-funktionella. Trots att det är en integrerad del av organismutvecklingen, forskare har ännu inte helt definierat de processer genom vilka celler blir polariserade.
Ett sätt att visualisera den asymmetriska karaktären hos cellulär sammansättning är att tänka på komponenterna i en bil och hur de är ordnade. Vissa delar av bilen måste placeras i en balanserad layout, till exempel hjulen. Andra komponenter måste arrangeras i en specifik orientering för att fungera korrekt, dvs. förarsätet måste vara placerat framför de bakre passagerarsätena. Till sist, komponenter som motorn kan placeras fram eller bak i bilen, och viktigare är att denna organisation ger olika egenskaper till bilens hantering. På samma sätt, arrangemanget av cellulära komponenter kan ha drastiska effekter på cellfunktionen.
Många av de existerande studierna på cellpolaritet har utförts i nematodmasken C. elegans. På encellsstadiet, embryot delar sig längs en främre/bakre axel för att generera två olika stora dotterceller, med en större cell framtill och en mindre cell bak. Denna främre/bakre axel etableras genom rörelse och segregering av en grupp proteiner som kallas PAR (partitionsdefekta) proteiner.
Dessa PAR-proteiner finns i cellbarken, ett dynamiskt lager av proteinfilament som ligger precis innanför cellmembranet. Innan polarisering, PAR-proteinerna är fördelade över hela cortex, där de rör sig fritt. Under polarisering, cortex drar ihop sig, och detta gör att olika PAR-proteiner separeras och ackumuleras på antingen fram- eller baksidan av cellen, därigenom bryta deras tidigare symmetriska organisation och etablera polaritet längs den främre/bakre axeln. Dock, mekanismen genom vilken kontraktil aktivitet transporterar och segregerar PAR-proteiner är fortfarande oklart.
Spänningsflöde
Teamet av forskare ledd av biträdande professor Fumio Motegi, Huvudutredare vid MBI och Temasek Life Sciences Laboratory, försökte svara på denna fråga genom att observera rörelsen av fluorescensmärkta PAR-proteinkomplex under mikroskopet i levande C. elegans-embryon när de genomgick polarisering. Med hjälp av avancerad mikroskopiteknik, de upptäckte att vissa PAR-proteiner samlades till kluster i början av polarisering, och dessa kluster växte i storlek allteftersom polariseringen fortskred. När kortikal kontraktion upphörde, klustren demonterade, med proteinerna som sprids ut som en gradient längs den främre/bakre axeln.
Trots dessa fynd, forskarna observerade inte ett direkt samband mellan de kontraktila fibrerna och PAR-proteiner, och detta ledde dem till hypotesen att en indirekt effekt av kontraktion var ansvarig för klustring. Genom att störa eller förstärka actomoysin cortex och observera effekten på klusterbildning, de upptäckte att nyckelkraften som driver PAR-klustring var kortikal spänning, som utvecklades när cortex drog sig samman.
Utifrån detta kunde forskarna föreslå en ny modell som förklarade segregeringen av PAR-proteiner. Här, sammandragning av actomyosin cortex leder till en ökning av kortikal spänning, vilket får PAR-proteinerna att samlas till kluster. När dessa stora kluster rör sig långsamt, de fastnar i det övergripande kortikala flödet och segregerar i ena änden av cellen, därigenom etablera polaritet. Dessa segregerade kluster av PAR-proteiner fungerar sedan som en ställning som förmedlar en lokal ackumulering av andra proteiner som behövs för upprättandet av främre/bakre axlar längs kroppen.
Mekanismen som upptäcktes i denna studie är ett enkelt men elegant exempel på hur celler använder inre krafter för att flytta och organisera sina proteinkomponenter på ett exakt, välordnat sätt. Viktigt, den kraftdrivna mekanismen som beskrivs tillåter cellen att etablera polaritet utan att slösa energi genom att aktivt transportera proteiner eller cellulära komponenter mot en koncentrationsgradient. Man tror att liknande mekanismer används för att bryta symmetri i andra organismer, inklusive människor, och man hoppas att denna nya kunskap kommer att hjälpa forskare att förstå hur och varför cellpolaritet misslyckas med att etableras korrekt i sjukdomar som cystisk fibros och cancer.