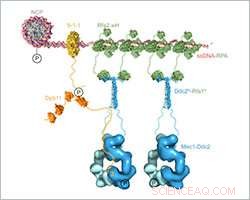
Storskalig sammansatt strukturell modell av Mec1-Ddc2-RPA-montering och aktivering vid DNA-skadeställen. Upphovsman:Friedrich Miescher Institute for Biomedical Research
Ishan Deshpande och hans kollegor från gruppen Susan Gasser och Protein Structure Facility på FMI belyste mekanismen för hur Mec1-Ddc2, en tumörundertryckare involverad i DNA -skadesvar samlas på platser för DNA -skada. De fokuserar på Ddc2-RPA-interaktionen, vilket leder Mec1-Ddc2-kinaskomplexet till enkelsträngat DNA vid platser för DNA-skada. Med sina strukturella data, FMI -forskarna tillhandahåller den saknade länken mellan två tidigare publicerade strukturer, tillåta dem att montera en skalad komposit strukturell modell av Mec1-Ddc2 på ssDNA-RPA vid DNA-skadeställen.
ATR -kinas har väckt intresse i över 20 år. Detta kinas är ett av två centrala DNA -skadeavkännande kinaser i däggdjursceller, och det är också en tumörsuppressor. Två föreningar som hämmar ATR -kinas finns i kliniska prövningar för behandling av leukemi och fasta tumörer. Än, hur detta enzym regleras på molekylär nivå har förblivit svårfångat.
Ishan Deshpande, en doktorand i proteinstrukturen och gruppen av Susan Gasser vid Friedrich Miescher Institute for Biomedical Research (FMI), har nu belyst mekanismen för hur jästhomologen för ATR, Mec1, samlas på platser med DNA-skada för platsspecifik aktivering.
I jäst, som hos människor, Mec1 bildar ett komplex med en reglerande subenhet som kallas Ddc2 (ATRIP hos människor). Vid DNA -skada, stora sträckor av enkelsträngad DNA (ssDNA) exponeras, som snabbt täcks av replikationsprotein A (RPA). Mec1-Ddc2 känner igen dessa ssDNA-RPA-sträckor och ackumuleras på dessa platser för att initiera reparationsmekanismer.
Deshpande och kollegor har nu löst 3D-strukturen för Ddc2 N-terminalen i anslutning till en del av RPA, vilket ger strukturella data om länken mellan RPA och Mec1, som hittills varit svårfångat. Vi erhöll en högupplöst samkristallstruktur av Ddc2 N-terminalen tillsammans med en subenhet av RPA, Deshpande förklarade. Med dessa uppgifter, vi kunde visa att Ddc2 bildar homodimerer och binder RPA med dess N-terminal. Intressant, vår Ddc2-RPA-struktur är den saknade länken mellan två tidigare publicerade strukturer, och detta gör att vi kan montera en skalad kompositkonstruktionsmodell av Mec1-Ddc2 på ssDNA-RPA vid DNA-skadeställen.
Ddc2 N-terminalen underlättar inte bara Mec1-interaktion med RPA utan fungerar också som ett distansorgan för Mec1-kinaset. Deshpande förklarar:Den långsträckta Ddc2 N-terminalen gör att den stora Mec1 kinasmodulen kan röra sig utan att stöta på det skadade DNA eller reparationsmaskineriet som arbetar vid lesionen. Dessutom, Ddc2 -distansen kan tillåta Mec1 att fosforylera flera rumsligt distinkta substrat medan den förblir bunden till platsen för DNA -skada. Du kan tänka på Ddc2 N-terminalen som en giraffhals som gör att giraffen kan nå gräset på marken liksom bladen på ett högt träd.
Korrekt Mec1-Ddc2-aktivitet är viktigt för alla typer av reparationer av DNA-skador. Dock, funktionella data från Deshpande och kollegor indikerar att Ddc2 N-terminalen är särskilt viktig för cellöverlevnad efter DNA-skada av UV-ljus. Vår modell tyder på att enbart rekrytering av Mec1-Ddc2 till ssDNA kan bidra till dess homodimerisering och därför aktivering av Mec1-Ddc2-komplexet, förklarar Deshpande.
Dessutom, Susan Gasser påpekar "att detta har varit ett underbart samarbete mellan mitt labb och FMI:s strukturanläggning, gör det möjligt för oss att överbrygga från struktur till funktion. "