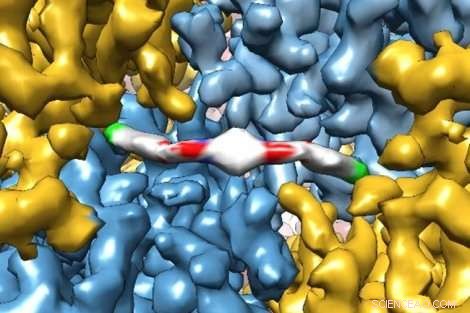
En banbrytande kryo-elektronmikroskopibild visar i extrem detalj hur en ny terapeutisk molekyl interagerar med ett protein, ge forskare insikter om hur det fungerar i människokroppen. Molekylen, ISRIB, visades i en ny studie av UCSF:s Peter Walter, PhD, och Susanna Rosi, Doktorsexamen, för att återställa minnesfel hos patienter med traumatisk hjärnskada. Upphovsman:Adam Frost Lab
Forskare från UC San Francisco tog nyligen utsökta bilder av ett protein som fångats på att binda till ett nytt terapeutiskt läkemedel med tillräcklig upplösning för att modellera hur de individuella atomerna i proteinet och läkemedlet radas upp.
Tills nyligen, en sådan bedrift skulle ha ansetts omöjlig, men under de senaste fem åren, sådana genombrott har blivit nästan vanliga här, del av en resolutionsrevolution som leds av UCSF-forskare.
Tack vare deras senaste framsteg inom kryo-elektronmikroskopi (cryo-EM)-en teknik vars uppfinnare hedrades med Nobelpriset i kemi 2017-har dessa forskare möjliggjort snabba framsteg i sökandet efter mer exakta och kraftfulla behandlingar för ett brett spektrum av mänskliga sjukdomar.
Proteiner är små molekylära maskiner som driver allt våra celler gör – och de är också de primära målen för farmaceutiska läkemedel. Att upptäcka hur nya proteiner fungerar kan leda till livräddande behandlingar för cancer eller nya smärtstillande medel med mindre risk för beroende.
Men för att verkligen förstå hur proteiner fungerar, forskare måste kunna visualisera dem i atomär skala. Tidigare krävde detta noggrant växande kristaller av ett protein – en process som kunde ta år att komma till rätta med – och sedan skjuta röntgenstrålar genom kristallerna för att beräkna proteinets atomsammansättning. Tyvärr, många av de mest intressanta proteinerna och komplexen kan inte kristalliseras.
Cryo-EM har funnits sedan 1970-talet, men sedan 2013 pionjärer tekniska framsteg delvis av UCSF:s David Agard, PhD, och Yifan Cheng, PhD, har dramatiskt förbättrat cryo-EM:s förmåga att lösa både de minsta och mest komplexa av proteiner i fantastisk detalj, förvandlar elektronmikroskopet från en gammaldags back-of-the-lab-arbetshäst till den senaste vetenskapliga superstjärnan nästan över en natt.
Denna cryo-EM-renässans ansporsades av Agard och Chengs ansträngningar att utveckla kamerahårdvara och programvara som kan upptäcka enstaka elektroner-ett mål som länge ansågs opraktiskt av fältet, men som duon åstadkom genom att sammanföra forskare och ingenjörer vid UCSF, Lawrence Berkeley National Laboratory, och Gatan, en Pleasanton, Kalifornien, företag som tillverkar EM-kameror.
"För inte länge sedan trodde hela fältet att räkna enstaka elektroner aldrig skulle fungera, " minns Cheng. "Men vid UCSF, kulturen fostrar oss att göra saker som alla andra tror är omöjliga."
Trots skepsisen hos många av sina kamrater, Agard och Cheng – som båda är professorer i biokemi och biofysik vid UCSF och Howard Hughes Medical Institutes utredare – insåg att fånga enstaka elektroner var avgörande för elektronmikroskops förmåga att lösa viktiga biologiska proteiner i tillräcklig detalj för att tillåta forskare att förstå deras funktion.
En illustration visar de kryo-EM-bilder som är möjliga före 2013 längst till vänster och mycket högre upplösta kryo-EM-bilder tillgängliga idag till höger. Dessa högupplösta bilder gör det möjligt för forskare att konstruera molekylära modeller av svårstudierade proteiner (längst till höger). Kredit:Martin Högbom/Kungliga Vetenskapsakademien
"Det är inte bara en fråga om att se proteiner lite tydligare, " Agard förklarade. "Det finns en exakt punkt där du går från att se ganska värdelösa blobbar till att direkt kunna tolka en molekyls struktur. Elektronräknarkameror gav verkligen ett kvantsprång i vår förmåga att förstå ett proteins underliggande kemi-både hur det fungerar och hur du kan designa läkemedel som binder till det. "
Sedan deras första storsäljande papper 2013 visade att de nya kamerorna och mjukvaran kunde lösa proteiner i nära atomär upplösning, Tekniken har fått bred användning inom fältet. Det har också möjliggjort stora framsteg inom Cheng och Agards egen forskning, från att förstå proteiner som är nyckeln till känslan av smärta, som skulle kunna bli föremål för en ny generation läkemedel, till upptäckter om hur proteiner bibehåller sin rätta form, vilket har stora konsekvenser för cancer och sjukdomar som Alzheimers sjukdom som kännetecknas av missformade proteiner.
En annan ledande cryo-EM-forskare vid UCSF, Adam Frost, MD, Doktorsexamen, som började på universitetet som biträdande professor 2014 för att dra nytta av kraften i denna nya teknik, har lett ansträngningarna att använda cryo-EM för att fastställa hur nya klasser av läkemedel binder till sina målproteiner på atomnivå.
"Cryo-EM is now allowing us to study proteins at a level of detail that would never have been possible just a few years ago, " Frost said.
Frost and Cheng have also been using cryo-EM to understand how signaling proteins on the surfaces of cells – key targets for pharmaceuticals from pain killers to cancer therapies – are influenced by the cell membranes in which they float and how proteins can bend and shape the membranes. I synnerhet, the ability to examine the structure of proteins in their native membranes – which had also been considered impossible by the field – was achieved for the first time in 2016 by Cheng.
The recent work with cryo-EM has been so successful that many researchers at UCSF have begun clamoring for a share of the limited microscopy time available on shared scopes. Lyckligtvis, with the acquisition earlier this year of new fully automated cryo-electron microscopes, including a $5 million state-of-the-art Titan Krios system funded by the Howard Hughes Medical Institute, a $6 million Titan Krios funded by an anonymous donor for the UCSF Institute of Neurodegenerative Disease – part of the UCSF Weill Institute for Neurosciences – and a $3 million Arctica system funded by the National Institutes of Health and UCSF, more and more researchers across the University and the Bay Area will be able to take their research to the next level.
Agard sees the cryo-EM revolution as closely synergistic to other burgeoning efforts on campus to completely map out the biology of disease, such as the work of Nevan Krogan, PhD, the director of UCSF's Quantitative Biosciences Institute, who is mapping the common networks of genes and proteins that drive diseases ranging from cancer to HIV to schizophrenia; and the work of Brian Shoichet, PhD, whose lab in UCSF's School of Pharmacy uses protein structures to computationally design custom drugs that fit like lock and key into target proteins.
"There is a remarkably integrated pipeline being developed at UCSF, with new technologies and approaches feeding off one another to advance our knowledge of the biology of disease at every level, " Agard said. "This is beginning to have a huge impact all around campus, but now we need to scale it up to lower barriers and speed the transition from images to therapies."