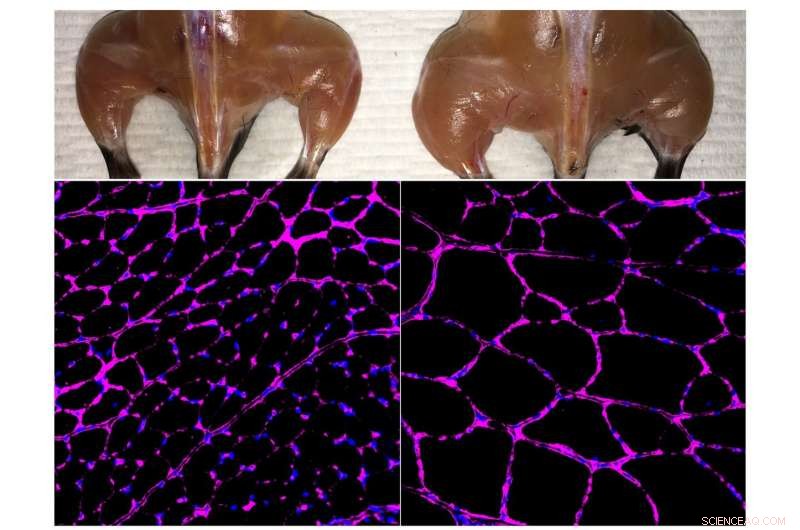
Belmonte-labbets avancerade in vivo Cas9-baserade epigenetiska genaktiveringssystem förbättrar skelettmuskelmassa (överst) och fiberstorlekstillväxt (nederst) i en behandlad mus (höger) jämfört med en oberoende kontroll (vänster). De fluorescerande mikroskopibilderna längst ner visar lila färgning av lamininglykoproteinet i tibialis anterior muskelfibrer. Kredit:Salk Institute
Salk-forskare har skapat en ny version av CRISPR/Cas9-genomredigeringsteknologin som gör att de kan aktivera gener utan att skapa avbrott i DNA:t. potentiellt kringgå ett stort hinder för att använda genredigeringstekniker för att behandla mänskliga sjukdomar.
De flesta CRISPR/Cas9-system fungerar genom att skapa "dubbelsträngsbrytningar" (DSB) i regioner av genomet som är inriktade på redigering eller radering, men många forskare är emot att skapa sådana brott i levande människors DNA. Som ett bevis på konceptet, Salk-gruppen använde sin nya metod för att behandla flera sjukdomar, inklusive diabetes, akut njursjukdom, och muskeldystrofi, i musmodeller.
"Även om många studier har visat att CRISPR/Cas9 kan användas som ett kraftfullt verktyg för genterapi, det finns en växande oro angående oönskade mutationer som genereras av dubbelsträngsbrotten genom denna teknik, " säger Juan Carlos Izpisua Belmonte, en professor i Salks Gene Expression Laboratory och senior författare till den nya artikeln, publiceras i Cell den 7 december, 2017. "Vi kunde komma runt den oro."
I det ursprungliga CRISPR/Cas9-systemet, enzymet Cas9 är kopplat med guide-RNA som riktar det till rätt plats i genomet för att skapa DSB. Nyligen, vissa forskare har börjat använda en "död" form av Cas9 (dCas9), som fortfarande kan rikta in sig på specifika platser i genomet, men skär inte längre DNA. Istället, dCas9 har kopplats ihop med transkriptionsaktiveringsdomäner - molekylära switchar - som sätter på riktade gener. Men det resulterande proteinet – dCas9 fäst vid aktivatoromkopplarna – är för stort och skrymmande för att passa in i den vehikel som vanligtvis används för att leverera den här typen av terapier till celler i levande organismer, nämligen adenoassocierade virus (AAV). Avsaknaden av ett effektivt leveranssystem gör det mycket svårt att använda detta verktyg i kliniska tillämpningar.
Izpisua Belmontes team kombinerade Cas9/dCas9 med en rad olika aktivatoromkopplare för att avslöja en kombination som fungerade även när proteinerna inte var sammansmälta med varandra. Med andra ord, Cas9 eller dCas9 paketerades i en AAV, och switcharna och guide-RNA:n packades in i en annan. De optimerade också guide-RNA för att se till att alla bitar hamnade på önskad plats i genomet, och att målgenen var starkt aktiverad.
"Komponenterna arbetar alla tillsammans i organismen för att påverka endogena gener, " säger Hsin-Kai (Ken) Liao, en personalforskare i labbet i Izpisua Belmonte och medförfattare till den nya artikeln. På det här sättet, tekniken fungerar epigenetiskt, vilket betyder att det påverkar genaktiviteten utan att ändra DNA-sekvensen.
För att testa metoden, forskarna använde musmodeller för akut njurskada, typ 1-diabetes och en form av muskeldystrofi. I varje fall, de konstruerade sitt CRISPR/Cas9-system för att öka uttrycket av en endogen gen som potentiellt skulle kunna vända sjukdomssymptomen. Vid njursjukdom, de aktiverade två gener kända för att vara involverade i njurfunktionen, och observerade inte bara ökade nivåer av proteinerna associerade med dessa gener, men förbättrad njurfunktion efter en akut skada. För typ 1-diabetes, de syftade till att öka aktiviteten hos gener som kunde generera insulinproducerande celler. Ännu en gång, behandlingen fungerade, sänka blodsockernivåerna i en musmodell av diabetes. För muskeldystrofi, forskarna uttryckte gener som tidigare har visat sig vända sjukdomssymptom, inklusive en särskilt stor gen som inte enkelt kan levereras via traditionella virusmedierade genterapier.
"Vi blev väldigt glada när vi såg resultaten i möss, " tillägger Fumiyuki Hatanaka, en forskarassistent i labbet och medförfattare till artikeln. "Vi kan inducera genaktivering och samtidigt se fysiologiska förändringar."
Izpisua Belmontes team arbetar nu för att förbättra specificiteten hos deras system och att tillämpa det på fler celltyper och organ för att behandla ett bredare spektrum av mänskliga sjukdomar, samt att föryngra specifika organ och att vända åldrandeprocessen och åldersrelaterade tillstånd som hörselnedsättning och makuladegeneration. Fler säkerhetstester kommer att behövas innan mänskliga försök, de säger.