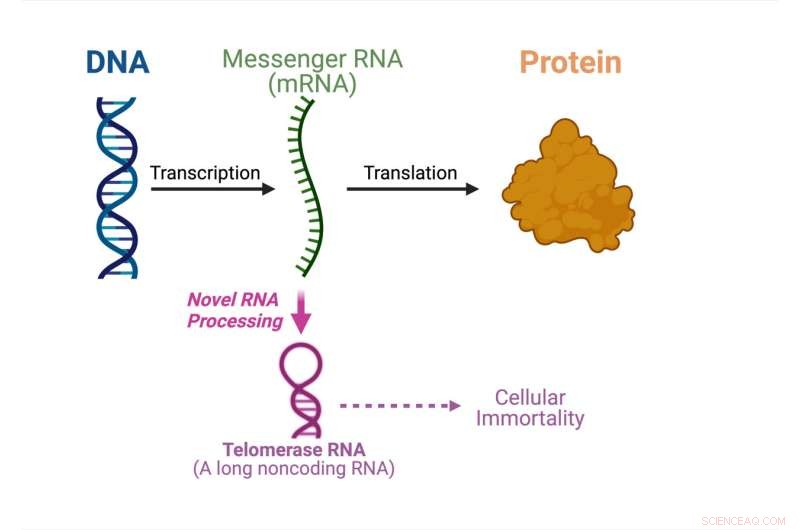
Den centrala dogmen inom molekylärbiologin visar vad som händer i denna studie. Kredit:Julian Chen
För allra första gången har en studie ledd av Julian Chen och hans grupp vid Arizona State Universitys School of Molecular Sciences och Biodesign Institute's Center for the Mechanism of Evolution upptäckt en aldrig tidigare skådad väg som producerar telomeras-RNA från ett proteinkodande budbärar-RNA ( mRNA).
Den centrala dogmen inom molekylärbiologi specificerar i vilken ordning genetisk information överförs från DNA för att göra proteiner. Messenger-RNA-molekyler bär den genetiska informationen från DNA:t i cellens kärna till cytoplasman där proteinerna tillverkas. Budbärar-RNA fungerar som budbärare för att bygga proteiner.
"Faktiskt finns det många RNA (ribonukleinsyror) som inte används för att göra proteiner," förklarade Chen. "Omkring 70 procent av det mänskliga genomet används för att göra icke-kodande RNA som inte kodar för proteinsekvenser men har andra användningsområden."
Telomeras-RNA är ett av de icke-kodande RNA:erna som samlas tillsammans med telomerasproteiner för att bilda enzymet telomeras. Telomeras är avgörande för cellulär odödlighet i cancer och stamceller. I denna studie visar Chens grupp att ett svamptelomeras-RNA bearbetas från ett proteinkodande mRNA istället för att syntetiseras oberoende.
"Vårt fynd från detta dokument är paradigmskiftande. De flesta RNA-molekyler syntetiseras oberoende och här har vi upptäckt ett mRNA med dubbel funktion som kan användas för att producera ett protein eller för att göra ett icke-kodande telomeras-RNA, vilket är verkligen unikt", säger Chen. "Vi kommer att behöva göra mycket mer forskning för att förstå den underliggande mekanismen för en sådan ovanlig RNA-biogenesväg."
Grundforskning om metabolism och reglering av mRNA har lett till viktiga medicinska tillämpningar. Till exempel använder flera COVID-19-vacciner budbärar-RNA som ett sätt att producera virala spikproteiner. I dessa vacciner bryts mRNA-molekylerna så småningom ned och absorberas sedan av våra kroppar.
Detta nya tillvägagångssätt har fördelar jämfört med DNA-vacciner som löper en potentiell risk att bli skadligt och permanent införlivat i vårt DNA. Upptäckten av biogenes av mRNA med dubbel funktion i detta arbete kan leda till innovativa sätt att tillverka framtida mRNA-vacciner.
I denna studie upptäckte Chens grupp det oväntade mRNA-härledda telomeras-RNA:t i modellsvamporganismen Ustilago maydis eller majssmuts. Majssmuts, även kallad mexikansk tryffel, är ätbar och ger en utsökt umamieffekt till många rätter, till exempel tamales och tacos. Studiet av RNA och telomerbiologi i majssmuts kan ge möjligheter att hitta nya mekanismer för mRNA-metabolism och telomerasbiogenes.
Varför studera telomeras-RNA?
Nobelpriset i fysiologi eller medicin delades ut 2009 "för upptäckten av hur kromosomer skyddas av telomerer och enzymet telomeras." Telomeras isolerades först från en encellig organism som lever i dammavskum. Som det senare visade sig, finns telomeras i nästan alla eukaryota organismer, inklusive människor, och spelar en avgörande roll vid åldrande och cancer. Forskare har försökt hitta sätt att använda telomeras för att göra mänskliga celler odödliga.
Typiska mänskliga celler är dödliga och kan inte förnya sig för alltid. Som visades av Leonard Hayflick för ett halvt sekel sedan har mänskliga celler en begränsad replikativ livslängd, med äldre celler som når denna gräns snabbare än yngre celler. Denna "Hayflick-gräns" för cellulär livslängd är direkt relaterad till antalet unika DNA-upprepningar som finns i ändarna av de genetiska materialbärande kromosomerna. Dessa DNA-upprepningar är en del av de skyddande täckstrukturerna, kallade "telomerer", som skyddar ändarna av kromosomerna från oönskade och obefogade DNA-omläggningar som destabiliserar genomet.
Varje gång cellen delar sig krymper det telomera DNA:t och kommer så småningom att misslyckas med att säkra kromosomändarna. Denna kontinuerliga minskning av telomerlängden fungerar som en "molekylär klocka" som räknar ner till slutet av celltillväxten.
Den minskade förmågan för celler att växa är starkt förknippad med åldrandeprocessen, där den minskade cellpopulationen direkt bidrar till svaghet, sjukdom och organsvikt.
Telomeras, enzymet som på ett unikt sätt har nyckeln till att fördröja eller till och med vända den cellulära åldrandeprocessen, motverkar krympningsprocessen. Telomeras kompenserar cellulärt åldrande genom att förlänga telomererna, lägga till tillbaka förlorade DNA-repetitioner för att lägga till tid på den molekylära klocknedräkningen, vilket effektivt förlänger cellens livslängd.
Telomeras förlänger telomerer genom att upprepade gånger syntetisera mycket korta DNA-upprepningar av sex nukleotider – byggstenarna i DNA – med sekvensen "GGTTAG" på kromosomändarna från en mall som finns i RNA-komponenten i själva enzymet.
Den gradvisa krympningen av telomerer påverkar replikationsförmågan hos mänskliga stamceller negativt, de celler som återställer skadade vävnader och/eller fyller på åldrande organ i våra kroppar. Aktiviteten av telomeras i vuxna stamceller saktar bara ner nedräkningen av den molekylära klockan och förevigar inte dessa celler helt. Därför blir vuxna stamceller utmattade hos åldrade individer på grund av att telomerlängden förkortas, vilket resulterar i ökade läkningstider och nedbrytning av organvävnad från otillräckliga cellpopulationer.
Utnyttja telomerasets fulla potential
Att förstå regleringen och begränsningen av telomerasenzymet har ett löfte om att vända telomerförkortning och cellulärt åldrande med potential att förlänga människans livslängd och förbättra välbefinnandet hos äldre individer.
Mänskliga sjukdomar som inkluderar dyseratosis congenita, aplastisk anemi och idiopatisk lungfibros har kopplats genetiskt till mutationer som negativt påverkar telomerasaktiviteten och/eller påskyndar förlusten av telomerlängd. Denna accelererade telomerförkortning påminner mycket om för tidigt åldrande med ökad organförsämring och en förkortad patientlivslängd orsakad av kritiskt otillräckliga stamcellspopulationer. Ökad telomerasaktivitet är till synes det mest lovande sättet att behandla dessa genetiska sjukdomar.
Medan ökad telomerasaktivitet kan föra ungdomar till åldrande celler och bota för tidigt åldrande-liknande sjukdomar, kan för mycket av det goda vara skadligt för individen. Precis som ungdomliga stamceller använder telomeras för att kompensera för förlust av telomerlängd, använder cancerceller telomeras för att upprätthålla sin avvikande och destruktiva tillväxt. Förstärkning och reglering av telomerasfunktionen måste utföras med precision och gå en smal linje mellan cellföryngring och en ökad risk för cancerutveckling.
Till skillnad från mänskliga stamceller utgör somatiska celler den stora majoriteten av cellerna i människokroppen och saknar telomerasaktivitet. Telomerasbristen hos mänskliga somatiska celler minskar risken för cancerutveckling, eftersom telomeras ger okontrollerad tillväxt av cancerceller. Därför är läkemedel som ökar telomerasaktiviteten urskillningslöst i alla celltyper inte önskvärda. Läkemedel med små molekyler kan screenas eller utformas för att öka telomerasaktiviteten uteslutande inom stamceller för sjukdomsbehandling såväl som antiaging-terapier utan att öka risken för cancer.
Studien av telomeras-RNA-biogenes i majssmuts kan avslöja nya mekanismer för telomerasreglering och erbjuda nya anvisningar om hur man modulerar eller konstruerar humant telomeras för innovationer inom utveckling av antiaging och anticancerterapi.
Denna studie, "Biogenes av telomeras-RNA från en proteinkodande mRNA-prekursor", publicerades just i Proceedings of the National Academy of Sciences . I ASU-teamet ingår förstaförfattarna postdoc Dhenugen Logeswaran och tidigare forskningsassistent professor Yang Li, doktorand Khadiza Akhter, tidigare postdoc Joshua Podlevsky (för närvarande vid Sandia National Labs, Albuquerque, New Mexico) och två studenter Tamara Olson och Katherine Fosberg.
Chen kommenterade också kalibern hos ASU-studenterna Tamara Olson och Katherine Fosberg, som arbetade i hans labb i över ett år. "De tillbringade mycket tid i labbet och var helt involverade i vår forskning." + Utforska vidare