Kredit:Samar A. Mahmoud et al, Cell Reports (2022). DOI:10.1016/j.celrep.2022.111405
I ny forskning som nyligen publicerats i tidskriften Cell Reports , ett team av scientists alltifrån universiteten av Massachusetts Amherst delved in i mysterierna av hur celler väderpåfrestning. Med hjälp av bakterieceller upptäckte forskarna att ett skadereparerande enzym, kallat ClpX, inte bara kan mutera för att fixa flera cellulära problem utan kan svara på förändrade nivåer av cellulär energi för att hjälpa till att hålla en cell frisk.
"Vad vi verkligen är intresserade av", säger Peter Chien, professor i biokemi och molekylärbiologi vid UMass Amherst och tidningens seniorförfattare, "är hur celler reagerar på stress. Vi studerar en klass av enzymer, kallade proteaser, som riktar sig mot och förstöra skadliga proteiner i en cell. Dessa proteaser kan selektivt känna igen specifika, individuella proteiner i singulära proteiner. Men hur gör de detta? Hur kan de välja mellan friska och skadliga proteiner?"
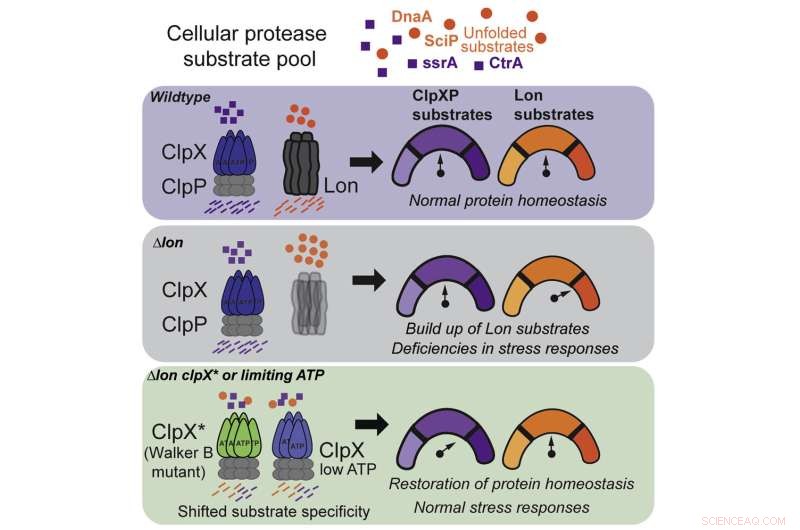
För att svara på denna fråga fokuserade Chien och hans medförfattare på två specifika proteaser, kända som Lon och ClpX, som var och en är utsökt inställd för att känna igen ett annat skadligt protein. Man hade länge trott att Lon och ClpX fungerade som nycklar:var och en kunde bara öppna ett specifikt lås och inget annat, och om en cell saknade någondera skulle allvarliga biverkningar uppstå.
"Om du någonsin har haft en extremt stökig collegerumskamrat", säger Chien, "vet du hur viktigt det är att tömma papperskorgen regelbundet. Att sakna Lon-proteasen är som att ha en rumskamrat som aldrig tvättar, byter eller städar."
Men efter en serie experiment som involverade radering av Lon från kolonier av bakterieceller, började Chiens team märka något konstigt:några av kolonierna överlevde.
Denna observation ledde till deras första upptäckt:ClpX kan mutera för att utföra en Lon-liknande funktion, även om det förlorar några av sina ClpX-förmågor. Det är som om du, för att hålla din sovsal ren, började tvätta din rumskamrats strumpor, men var tvungen att offra lite av din egen rena tvätt för att göra det.
I att spåra ut exakt hur ClpX-mutationen tillät proteaset att utöka sin funktion, gjorde teamet sin andra upptäckt:Vilda, icke-muterade ClpX kan också utföra några av Lons uppgifter, under rätt förhållanden.
Det visar sig att ClpX är mycket känsligt för ATP, en organisk förening som är energikällan för alla levande celler. Vid normala nivåer av ATP fokuserar ClpX på sina egna uppgifter, men vid en specifik, lägre tröskel börjar den plötsligt städa upp efter Lon.
"Detta är ett verkligt genombrott i den grundläggande förståelsen av hur celler fungerar", säger Chien. "Det ändrar reglerna:inte bara styr cellulär energi hur snabbt en cell fungerar, utan hur den fungerar också." + Utforska vidare