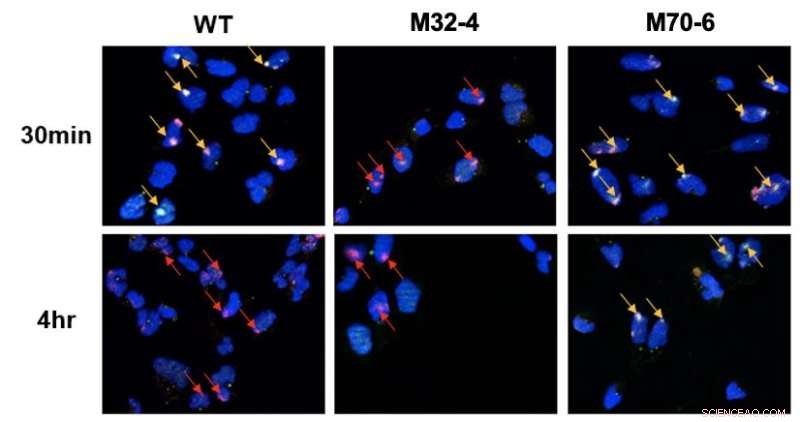
Distinkt roll för interaktionerna mellan RPA32 och RPA70 med XPA i NER. Celler bestrålades med UV och samlokaliseringen av XPA med UV-skadeställen visualiserades med fluorescensmikroskopi. DNA-skador markeras med röda pilar och samlokalisering av XPA med UV-DNA indikeras med gula pilar. I XPA-RPA32-mutantceller (M32-4) observerades reducerad XPA-rekrytering till DNA-skada. I XPA-RPA70 mutantceller (M70-6) förblev XPA bundet vid skadade ställen under en längre tid. Detta indikerar att RPA32-interaktion med XPA krävs för rekrytering av XPA till UV-inducerad skada, medan RPA70-interaktion med XPA är viktig för positionering av XPA för slutförande av NER. Kredit:Institutet för grundvetenskap
Nukleotidexcisionsreparation (NER) är en viktig bevarad DNA-reparationsväg, som reparerar olika typer av skador i genomet, såsom de som induceras av ultraviolett ljus och miljöagenter. Dysfunktion i denna väg kan vara skadlig för människors hälsa. Till exempel lider individer med defekter i NER av xeroderma pigmentosum, en sjukdom som kännetecknas av en extrem disposition för solljusinducerad hudcancer på grund av oförmåga att reparera UV-skadat DNA.
Samtidigt som NER därmed motverkar cancerbildning, är det också viktigt för antitumörbehandling. Många antitumörmedel, såsom cisplatin, inducerar skador på DNA som kan repareras av NER. I detta sammanhang är NER ett läkemedelsmål av intresse för att förbättra resultaten av cancerterapi. På molekylär nivå är NER en mycket komplex och dynamisk molekylär maskin, som involverar över 30 proteiner som samlas vid DNA-skador för att skära ut skadan och ersätta den med intakt DNA. Denna process styrs av protein-protein- och protein-DNA-interaktioner.
Ett team av forskare under ledning av biträdande direktören Orlando D. Schärer och doktorand Kim Mihyun från Center for Genomic Integrity inom Institutet för grundläggande vetenskap, Sydkorea, utforskade dessa interaktioner. Teamet fann att två nyckelproteiner i NER, nämligen xeroderma pigmentosum protein A (XPA) och replikationsprotein A (RPA) proteiner, krävs för att organisera pre-incisionskomplexet i NER.
De två proteinerna XPA och RPA är ansvariga för organisationen av NER-komplexet efter att det har hittat skadan i DNA. Den aktuella studien jämförde mutanta varianter av dessa två proteiner för att undersöka hur de två proteinerna engagerar sig i en central interaktion för NER-vägen. Specifikt upptäcktes att två interaktionsgränssnitt mellan XPA och RPA är avgörande för NER och har distinkta roller i vägen. Interaktionen mellan XPA och RPA32 är avgörande för den initiala associationen mellan XPA och DNA-skada, medan interaktionen mellan XPA och RPA70 är viktig för fullbordandet av NER.
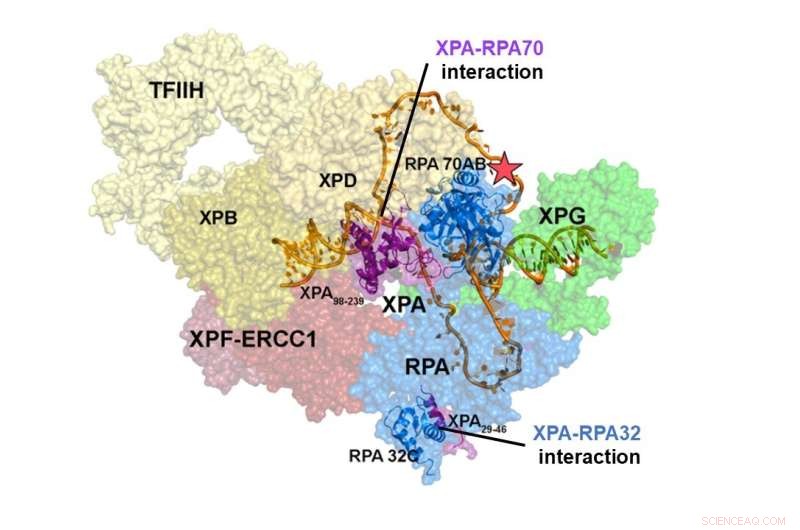
Struktur av NER pre-incision komplex. Interaktionen mellan XPA och RPA70 är lokaliserad i mitten av NER-komplexet, medan interaktionsstället för XPA och RPA32 är i periferin. Interaktionerna mellan XPA och RPA70 stabiliserar pre-incision-komplexet och drar ihop DNA:t för att anta en U-form, vilket verkar vara den aktiva formen av komplexet, vilket gör att det kan ta bort DNA-skadan. Kredit:Institutet för grundvetenskap
Integrativa strukturella studier av ett XPA-RPA-DNA-komplex avslöjade hur interaktionerna mellan de två proteinerna formar NER-komplexet och utlöser excision av skadan. Interaktionen mellan XPA och RPA32 sker i periferin av komplexet, där det underlättar den initiala sammansättningen av proteinerna vid skadeplatsen. Interaktionen mellan XPA och RPA70 är belägen i hjärtat av NER-komplexet och tvingar DNA:t till en U-form. Detta gör att de två ss/dsDNA-kopplingarna kan lokaliseras i omedelbar närhet, vilket gör att NER-komplexet kan snitta DNA:t för att ta bort skadan.
Schärer uppgav att deras "studie avslöjade en överraskande ny modell av NER-komplexet och hur interaktionen mellan XPA och RPA formar dess arkitektur. Avbrott i interaktionen mellan XPA och RPA hämmar NER, och vår studie ger en plan för hur denna interaktion kan vara målinriktade av små molekyler för att förbättra cancerterapin. Vi fortsätter att bedriva uppföljningsforskning tillsammans med vår långvariga samarbetspartner i detta projekt, professor Walter Chazin vid Vanderbilt University."
Denna forskning publicerades i Proceedings of the National Academy of Sciences . + Utforska vidare