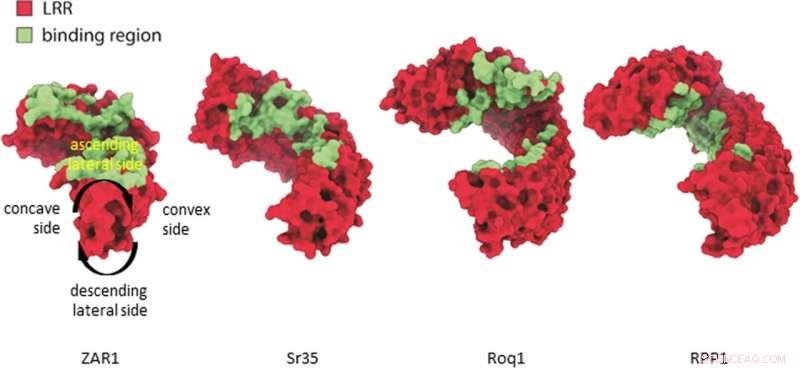
Jämförelse av ZAR1, Sr35, ROQ1, RPP1 ligandbindningsställen. Ligandbindning till LRR av CNLs (Zar1, Sr35) och LRR-CJID av TNLs (Roq1, RPP1) sker i motsvarande region i den stigande laterala sidan av LRR-domänen (jämför konkava, konvexa, stigande och fallande laterala sidor definierade på Zar1) . Kredit:Natur (2022). DOI:10.1038/s41586-022-05231-w
Forskare från Max Planck Institute for Plant Breeding Research och University of Cologne i Tyskland har tillsammans med kollegor från Kina reda ut hur vete skyddar sig mot en dödlig patogen. Deras resultat, publicerade i tidskriften Nature , skulle kunna utnyttjas för att göra viktiga växtarter mer motståndskraftiga mot sjukdomar.
Som basföda för 40 % av världens befolkning är det svårt att överskatta vikten av vete för livsmedelsförsörjningen.
Grödornas motståndskraft i ett föränderligt klimat och motståndskraft mot infektionssjukdomar kommer att vara de begränsande faktorerna för framtida livsmedelsstabilitet. När det gäller vete är en av de ekonomiskt mest betydelsefulla patogenerna stamrost, en ond svamp som kan ha förödande effekter på skörden.
Även om stamrost har infekterat vete sedan förkristen tid, hade det genom ansträngningar från uppfödare och växtpatologer varit möjligt att förhindra betydande epidemier i världens stora veteodlingsområden under de senaste 50 åren av 20 th århundrade. Tyvärr krossades denna rosiga bild 1998, med uppkomsten av en ny, mycket virulent variant av vetestamrost i Uganda.
Ug99, som det är känt, kan angripa upp till 80 % av världens vetesorter, vilket i vissa fall resulterar i fullständig förlust av skörd från infekterade fält. När de försöker förse grödor med resistens mot nya och framväxande växtpatogener söker växtforskare och uppfödare ofta vilda sorter av några av våra basgrödor efter gener som kan ge effektiv immunitet. Uppkomsten av Ug99 gav en särskild impuls till sådana ansträngningar och ledde till identifieringen av Sr35, en gen som skyddar mot Ug99 när den introduceras i brödvete.
Nu har forskare under ledning av Jijie Chai och Paul Schulze-Lefert från universitetet i Köln och Max Planck Institute for Plant Breeding Research i Köln, Tyskland, och Yuhang Chen från Chinese Academy of Sciences, Kina, avkodat strukturen för Sr35 veteprotein. Detta gjorde det möjligt för dem att förklara hur Sr35 skyddar Einkornvete mot Ug99.
Sr35 är ett exempel på en nukleotidbindande leucinrik repeterande (NLR)-receptor inuti växtceller som detekterar närvaron av invaderande patogener. NLR-aktivering utlöses av igenkännandet av patogena "effektorer", små proteiner som levereras till växtceller genom att invadera mikroorganismer för att försvaga växten. Varje NLR binder vanligtvis till en typ av effektor.
När Sr35 aktiveras samlas fem receptorer till ett stort proteinkomplex, som forskarna kallar "Sr35-resistosomen". Sådana resistosomer har förmågan att fungera som kanaler i växtcellmembranet. Denna kanalaktivitet sätter igång kraftfulla immunsvar som kulminerar i växtcellers självmord på infektionsplatsen som ett slags självuppoffring för att skydda resten av växten.
I den här studien lyckades forskarna för första gången lösa strukturen och beskriva immunfunktionen hos en resistosom från en gröda.
Forskarna började med att syntetisera både Sr35 och dess motsvarande Ug99-effektor i insektsceller, en strategi som gjorde det möjligt för dem att isolera och rena stora mängder Sr35-resistosomer, och använde kryogen elektronmikroskopi, en teknik där prover fryses till kryogena temperaturer som möjliggör bestämning av biomolekylära strukturer vid atomär upplösning.
Alexander Förderer, som ledde studien, säger:"I strukturen av Sr35 kunde vi identifiera de delar av proteinet som är viktiga för Ug99-effektorigenkänning. Med denna insikt hoppas jag att vi kan generera nya NLR:er som kan tillämpas i fältet att skydda eliten av vetesorter mot Ug99 och på så sätt bidra till global livsmedelssäkerhet."
Beväpnade med sin kunskap om strukturen hos Sr35-resistosomen började Alexander Förderer och hans medförfattare Ertong Li och Aaron W. Lawson avgöra om de nu kunde återanvända icke-funktionella receptorer av mottagliga elitsorter av korn och vete för att känna igen Ug99 effektor. De kom på två proteiner som, även om de liknar Sr35, inte känner igen Ug99. När de bytte in elementen i Sr35 som är kända för att kontakta Ug99-effektorn, kunde forskarna förvandla dessa proteiner till receptorer för Ug99-effektorn.
Enligt Paul Schulze-Lefert, "Denna studie illustrerar också hur naturen har använt en gemensam designprincip för att bygga immunreceptorer. Samtidigt har dessa receptorer utvecklats på ett sådant sätt att de har behållit flexibiliteten att generera nya receptorvarianter som kan ge immunitet mot andra mikrobiella patogener som virus, bakterier eller nematoder."
Jijie Chai påpekar att de insikter som erhållits i denna studie "öppnar möjligheten att förbättra resistens mot grödor genom att konstruera växtresistensproteiner som känner igen en rad olika patogeneffektorer." + Utforska vidare