Kredit:University of Cologne
En ny studie visar att proteinet CHIP kan reglera insulinreceptorn mer effektivt ensamt än i ett parat tillstånd. I cellulära stresssituationer uppträder CHIP vanligtvis som en homodimer - en förening av två identiska proteiner - och tjänar främst till att bryta ned felveckade och defekta proteiner. CHIP rensar alltså upp cellen. För detta ändamål samarbetar CHIP med hjälparproteiner för att fästa en kedja av det lilla proteinet ubiquitin till felveckade proteiner. De defekta proteinerna känns alltså igen och elimineras av cellen. Dessutom reglerar CHIP också signaltransduktionen av insulinreceptorn. CHIP binder ubiquitin till receptorn för att bryta ned den och stoppa aktiveringen av livsförlängande genprodukter.
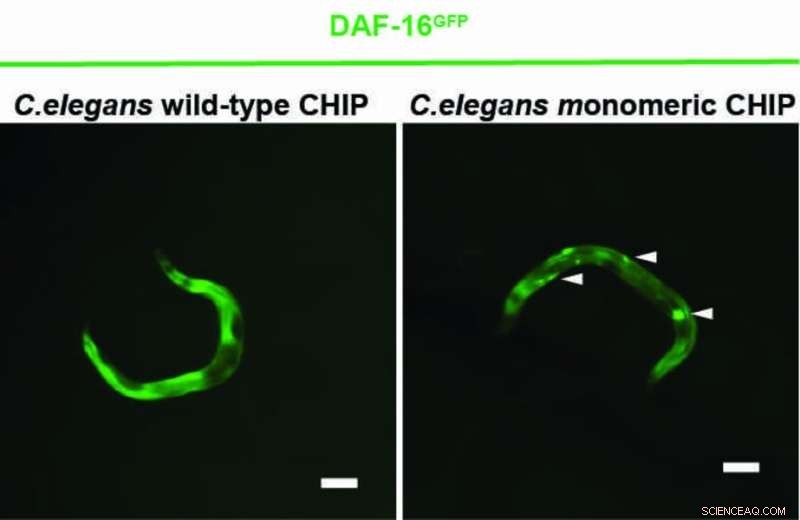
Ett Kölnbaserat forskarlag under ledning av prof Dr Thorsten Hoppe har nu visat i experiment med nematoden Caenorhabditis elegans och mänskliga celler att CHIP också kan märka sig själv med ubiquitin, vilket förhindrar dess dimerbildning. CHIP-monomeren är mer effektiv än CHIP-dimeren för att reglera insulinsignalering. Studien från University of Cologne's Cluster of Excellence for Cellular Stress Responses in Aging-Associated Diseases (CECAD) publicerades i Molecular Cell under rubriken "En dimer-monomer-switch styr CHIP-beroende substratubiquitylering och bearbetning."
"Om CHIP fungerar ensamt eller som ett par beror på cellens tillstånd. Under stress finns det för många felveckade proteiner såväl som hjälpproteinerna som binder till CHIP och förhindrar auto-ubiquitylering, självmärkningen med ubiquitin." sade Vishnu Balaji, första författare till studien.
"Efter att CHIP framgångsrikt har rensat upp de defekta proteinerna kan det också markera hjälpproteinerna för nedbrytning. Detta gör att CHIP kan ubiquitylera sig själv och fungera som en monomer igen", förklarade han. För att kroppen ska fungera smidigt måste det alltså finnas en balans mellan de monomera och dimera tillstånden i CHIP.
"Det är intressant att monomer-dimerbalansen i CHIP verkar vara störd i neurodegenerativa sjukdomar", säger Thorsten Hoppe. "I spinocerebellar ataxi, till exempel, är olika platser av CHIP muterade, och det fungerar övervägande som en dimer. Här skulle en övergång till fler monomerer vara ett möjligt terapeutiskt tillvägagångssätt."
I nästa steg vill forskarna ta reda på om det finns andra proteiner eller receptorer som CHIP-monomeren binder till och därmed reglerar deras funktion. Forskarna är också intresserade av att ta reda på i vilka vävnader och organ och i vilka sjukdomar CHIP-monomerer eller -dimerer förekommer i större mängd, för att i framtiden kunna utveckla mer riktade terapier. + Utforska vidare