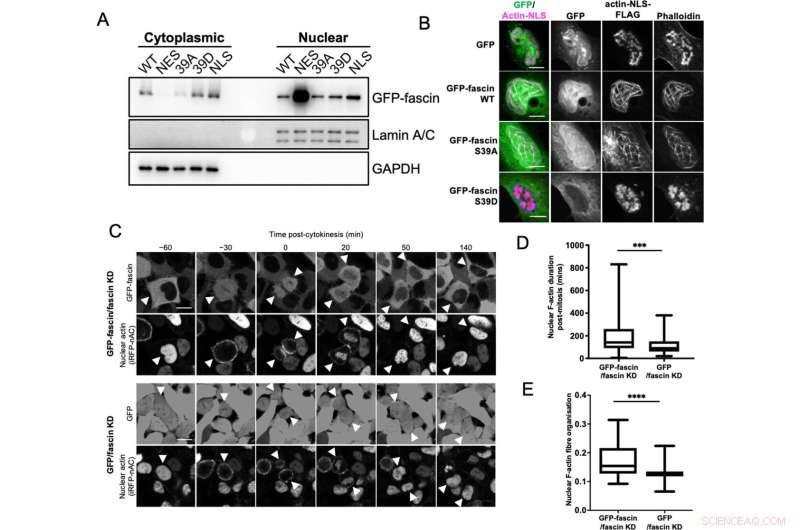
Kärnfascin bidrar till buntning av F-aktin. (A) Representativ western blöt av fascin knockdown (KD) HeLa-celler som uttrycker specificerade GFP-fascinkonstruktioner utsatta för biokemisk fraktionering. Nukleära och cytoplasmatiska avdelningar sonderade för GFP-fascin (80 kDa), Lamin A/C (69/62 kda) och GAPDH (36 kDa). Representant för tre oberoende experiment. (B) Representativa konfokala bilder av kärnor av fascin KD HeLa-celler som samuttrycker specificerade GFP-fascin-konstruktioner (grön) och aktin-NLS-FLAG-konstruktion, fixerade och färgade för FLAG (magenta) och F-aktin (falloidin). Skalstaplar är 10 µm. (C) Representativa stillbilder från konfokala tidsförloppsfilmer av fascin KD HeLa-celler som samtidigt uttrycker GFP eller GFP-fascin (översta paneler) och iRFP-nAC nukleär F-aktin-sond (nedre paneler) före och efter cytokines. Pilspetsar pekar på delande celler eller dotterceller. Skalstaplar är 10 µm. (D) Kvantifiering av varaktigheten av nukleära F-aktinfilament i celler som i (C). (E) Organisation av nukleärt F-aktin i synkroniserade celler, 10 timmar efter frisättning. För (D) och (E), N=89–100 celler/tillstånd, sammanslagna från tre oberoende experiment. Grafer visar min/max och medelvärde av dataset. ***=p <0,001, ****=p <0,0001. Kredit:eLife (2022). DOI:10.7554/eLife.79283
Forskare har visat att ett protein som kallas fascin verkar i cancercellers kontrollcenter och påverkar deras förmåga att reparera sig själva, växa och röra sig, enligt en studie publicerad idag i eLife .
Studien avslöjar en viktig väg genom vilken fascin främjar cancerutveckling och ger insikter om potentiella vägar som kan blockera dess verkan.
Fascin är känt för att styra strukturerna som tillåter celler att röra sig - speciellt sammansättningen av buntar av ett protein som kallas aktin, som skapar de små "benen" som cancerceller använder för att migrera till avlägsna platser i kroppen. Fascin är också känt för att vara på mycket högre nivåer i de flesta solida tumörer, där det hjälper cancerceller att migrera och invadera in i andra vävnader. Denna invasion - eller "metastasering" - av tumörceller är huvudorsaken till att många cancerformer är så svåra att behandla
"Vi har tidigare visat att fascin finns i cellens kontrollcenter - kärnan - vid vissa tidpunkter i cellens tillväxtcykel", förklarar huvudförfattaren Campbell Lawson, forskningsassistent vid Randall Center for Cell and Molecular Biophysics, King's College London , U.K. "Det var dock inte känt hur fascinens rörelse eller funktion inom kärnan kontrolleras, och detta hindrar vår förmåga att utveckla behandlingar som blockerar dess roll för att främja cancertillväxt och spridning."
För att förstå fascin ytterligare skapade teamet en serie cancercellinjer med och utan funktionell fascin, såväl som en serie fascin "nanokroppar" märkta med fluorescerande markörer, för att ändra dess placering i celler och utforska dess interaktioner med andra proteiner i kärna.
De fann att fascin aktivt transporteras in och ut ur kärnan och, när det väl är där, stödjer det sammansättningen av aktinknippen. Faktum är att celler utan fascin inte kunde bygga nukleära aktinknippen i samma utsträckning. Fascin interagerade också med en annan grupp viktiga proteiner i cellkärnan, som kallas histoner. När fascin inte är inblandat i att bunta aktin, är det bundet till histon H3 – en viktig aktör som är involverad i att organisera DNA i kärnan.
Med tanke på interaktionen mellan fascin och histoner, tittade teamet på om fascin också var involverat i DNA-reparationsprocesser i cancerceller, vilket hjälper dem att överleva. De fann att DNA-reparation var försämrad i celler som saknar fascin, vilket indikerar att proteinet kan behövas för att cancerceller ska utlösa deras svar på DNA-skador orsakade av kemo- eller strålbehandling. Fascinutarmade celler hade också förändringar i sin kromatinstruktur – hur DNA packas i cellen – jämfört med celler med normala fascinnivåer.
Även om kärnfascin spelar en viktig roll vid sammansättning av kärnaktin, DNA-struktur och reparation, är det också viktigt i cellcytoplasman, där det hjälper cancerceller att bygga små bihang som kallas filopodia, som främjar invasion. Så teamet ville förstå om att flytta all fascin in i kärnan skulle förhindra den cytoplasmatiska funktionen av fascin.
Som de förutsåg, i celler med förstärkt nukleär fascin, minskade antalet filopodia signifikant eftersom det inte fanns någon fascin i cytoplasman för att stödja sammansättningen av dessa strukturer. Cellerna invaderade också mindre i 3-dimensionella byggnadsställningar som efterliknar vävnaden som omger tumörer. Viktigt är att celler som hade tvingat fram kärnfascin hade signifikant minskad tillväxthastighet och livsduglighet eftersom de samlade stora stabila aktinknippen i kärnan som hindrade dem från att gå igenom cellcykeln. Sammantaget indikerar dessa resultat att, snarare än att försöka hitta sätt att blockera fascin, kan det att tvinga in det hela i cancercellernas kärna förhindra deras tillväxt och rörelse.
"Vår studie ger insikter i en ny roll för fascin i att kontrollera nukleär aktinbuntning för att stödja tumörcellernas livskraft", avslutar seniorförfattaren Maddy Parsons, professor i cellbiologi vid Randall Center for Cell and Molecular Biophysics, King's College London. "Med tanke på att fascin är på mycket höga nivåer i många solida tumörer, men inte i normala vävnader, är denna molekyl ett intressant terapeutiskt mål. Vi föreslår att främja fascinackumulering i kärnan av cancerceller, snarare än att bara fokusera på att rikta den i cellen. cytoplasma, kan vara ett alternativt tillvägagångssätt som skulle förhindra både tumörtillväxt och spridning." + Utforska vidare