Neisseria gonorrhoeae-bakterier kan ha drivit utvecklingen av mänskliga genvarianter som skyddar mot demens. Kredit:National Institute of Allergy and Infectious Diseases, National Institutes of Health
Forskare vid University of California San Diego School of Medicine har tidigare hittat en uppsättning mänskliga genmutationer som skyddar äldre vuxna mot kognitiv nedgång och demens. I en ny studie, publicerad 9 juli 2022 i Molecular Biology and Evolution , fokuserar de på en av dessa muterade gener och försöker spåra dess utveckling – när och varför den dök upp i det mänskliga genomet. Fynden tyder på att selektivt tryck från infektiösa patogener som gonorré kan ha främjat uppkomsten av denna genvariant i Homo sapiens, och oavsiktligt stödde existensen av morföräldrar i det mänskliga samhället.
Biologin hos de flesta djurarter är optimerad för reproduktion, ofta på bekostnad av framtida hälsa och längre livslängder. Faktum är att människor är en av de enda arter som är kända för att leva långt efter klimakteriet. Enligt "mormorshypotesen" beror detta på att äldre kvinnor ger viktigt stöd för att uppfostra mänskliga spädbarn och barn, som kräver mer vård än ungar av andra arter. Forskare försöker nu förstå vilka egenskaper hos människans biologi som gör denna långsiktiga hälsa möjlig.
När forskare tidigare jämförde människans och schimpansens genom fann de att människor har en unik version av genen för CD33, en receptor som uttrycks i immunceller. Standard CD33-receptorn binder till en typ av socker som kallas sialinsyra som alla mänskliga celler är belagda med. När immuncellen känner av sialinsyran via CD33 känner den igen den andra cellen som en del av kroppen och angriper den inte, vilket förhindrar ett autoimmunsvar.
CD33-receptorn uttrycks också i hjärnans immunceller som kallas mikroglia, där den hjälper till att kontrollera neuroinflammation. Emellertid har mikroglia också en viktig roll för att rensa bort skadade hjärnceller och amyloidplack associerade med Alzheimers sjukdom. Genom att binda till sialinsyrorna på dessa celler och plack undertrycker vanliga CD33-receptorer faktiskt denna viktiga mikrogliafunktion och ökar risken för demens.
Det är här den nya genvarianten kommer in. Någonstans längs den evolutionära linjen plockade människor upp ytterligare en muterad form av CD33 som saknar sockerbindningsstället. Den muterade receptorn reagerar inte längre på sialinsyror på skadade celler och plack, vilket gör att mikroglia kan bryta ner dem. I själva verket visade sig högre nivåer av denna CD33-variant oberoende av varandra vara skyddande mot sent debuterande Alzheimers.
I ett försök att förstå när denna genvariant först dök upp, hittade co-seniorförfattaren Ajit Varki, MD, framstående professor i medicin och cellulär och molekylär medicin vid UC San Diego School of Medicine, och kollegor bevis på starkt positivt urval, vilket tyder på att något drev genen att utvecklas snabbare än förväntat. De upptäckte också att just denna version av CD33 inte fanns i arvsmassan hos neandertalare eller denisovaner, våra närmaste evolutionära släktingar.
"För de flesta gener som är olika hos människor och schimpanser har neandertalarna vanligtvis samma version som människorna, så detta var verkligen överraskande för oss", sa Varki. "Dessa fynd tyder på att friska morföräldrars visdom och omsorg kan ha varit en viktig evolutionär fördel som vi hade jämfört med andra forntida homininarter."
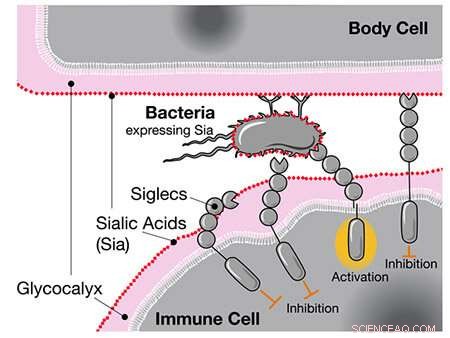
När Siglecs som CD33 känner av mänskliga sialinsyror, hämmar de immuncellens svar, även om dessa syror finns på bakterier. Kredit:UC San Diego Health Sciences
Varki ledde studien med Pascal Gagneux, Ph.D., professor i patologi vid UC San Diego School of Medicine och professor vid institutionen för antropologi. Författarna sa att studien ger nya bevis som stöder mormors hypotes.
Ändå säger evolutionsteorin att reproduktiv framgång är den främsta drivkraften för genetiskt urval, inte postreproduktiv kognitiv hälsa. Så vad var det som drev på förekomsten av denna muterade form av CD33 hos människor?
En möjlighet, föreslår författarna, är att mycket infektionssjukdomar som gonorré, som kan vara skadliga för den reproduktiva hälsan, kan ha påverkat människans evolution. Gonorrébakterier täcker sig med samma sockerarter som CD33-receptorer binder till. Som en varg i fårakläder kan bakterierna lura mänskliga immunceller att inte identifiera dem som inkräktare utifrån.
Forskarna föreslår att den muterade versionen av CD33 utan ett sockerbindande ställe uppstod som en mänsklig anpassning mot sådan "molekylär mimik" av gonorré och andra patogener. De bekräftade faktiskt att en av de mänskliga specifika mutationerna helt kunde avskaffa interaktionen mellan bakterierna och CD33, vilket skulle tillåta immunceller att attackera bakterierna igen.
Sammantaget tror författarna att människor från början ärvde den muterade formen av CD33 för att skydda mot gonorré under reproduktiv ålder, och denna genvariant valdes senare av hjärnan för dess fördelar mot demens.
"Det är möjligt att CD33 är en av många gener som väljs ut för sina överlevnadsfördelar mot infektiösa patogener tidigt i livet, men som sedan selekteras sekundärt för sina skyddande effekter mot demens och andra åldranderelaterade sjukdomar", säger Gagneux.
Medförfattare inkluderar Sudeshna Saha, Naazneen Khan, Andrea Verhagen, Aniruddha Sasmal och Sandra Diaz vid UC San Diego; Troy Comi och Joshua M. Akey vid Princeton University; Hai Yu och Xi Chen vid UC Davis, och Martin Frank på Biognos AB.