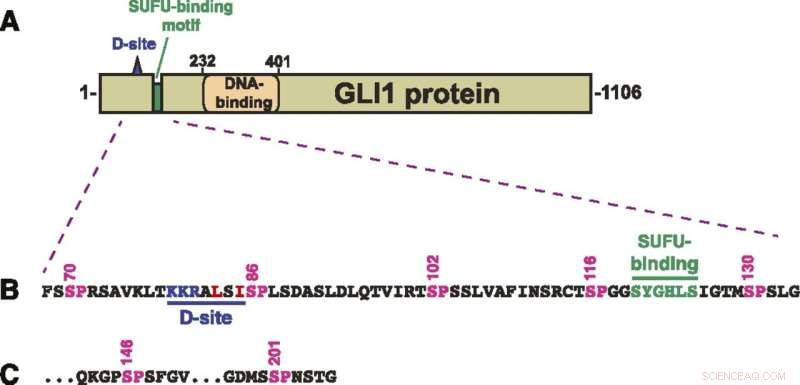
Struktur av GLI1-protein. (A) Schematisk över den primära strukturen av humant GLI1-protein, som visar MAPK-dockningsstället (D-ställe), det SUFU-bindande motivet och zinkfingrets DNA-bindande domän. Den transkriptionella aktiveringsdomänen utgör en stor del av den C-terminala hälften av proteinet. (B) Aminosyrasekvens av resterna 68–134, som visar D-platsen, det SUFU-bindande motivet och ett kluster av fem kanoniska MAPK-fosforyleringsställen (SP). Siffrorna ovan visar positionen för serinresterna i SP-ställena. (C) De två sista av de sju SP MAPK-fosforyleringsställena innehöll rester av 68-232 GLI1. Efter S201 inträffar nästa SP- eller TP-plats vid S441. Kredit:A. Jane Bardwell et al, Life Science Alliance (2022). DOI:10.26508/lsa.202101353
Bättre behandlingar för några av cancers dödligaste former skulle kunna vara närmare på grund av en upptäckt från University of California, Irvine om hur ett visst protein aktiveras i tumörceller. Fyndet, som leds av forskare med School of Biological Sciences, kan så småningom leda till möjliga terapier för det särskilt farliga melanomet och bukspottkörteladenokarcinomet, såväl som den vanligaste typen av hjärncancer hos barn och vuxenhudcancer. En artikel som beskriver projektet visas i Life Science Alliance .
Upptäckten gäller proteinet GLI1, som är viktigt i cellutvecklingen men som även har visat sig vara påslaget i olika cancerformer. GLI1 aktiveras vanligtvis av Hedgehog-signalvägen, känd som HH. Men forskare har vetat i ungefär ett decennium att överhörning (interaktion) mellan HH och den mitogenaktiverade proteinkinasvägen har en roll i cancer.
"I vissa fall kan proteiner i en väg aktivera proteiner i en annan", säger huvudförfattaren A. Jane Bardwell, projektforskare vid UCI:s avdelning för utvecklings- och cellbiologi. "Det är ett komplext system. Vi ville förstå den molekylära mekanismen som leder till att GLI1 aktiveras av proteiner i MAPK-vägen."
GLI1 binder normalt tätt till ett protein som kallas SUFU. Det proteinet undertrycker GLI1, vilket hindrar det från att penetrera cellkärnor och slå på gener. Forskarna undersökte sju platser på GLI1-proteinet som kunde fosforyleras eller ha en fosfatgrupp överförd till den.
"Vi identifierade tre som kan fosforyleras och som är involverade i att försvaga bindningen mellan GLI1 och SUFU", säger Lee Bardwell, professor i utvecklings- och cellbiologi, vars laboratorium genomförde projektet. "Denna process aktiverar GLI1, vilket gör att den kan komma in i cellkärnan, där den kan orsaka okontrollerad tillväxt som resulterar i cancer."
Han noterade att fosforylering av alla tre platserna orsakar en betydligt högre nivå av GLI1-flykt från SUFU än om bara en eller till och med två av dem får fosfatgrupper.
Upptäckten är ett viktigt steg mot mer effektiva och personliga cancerbehandlingar. "Om vi kan förstå exakt vad som händer i en viss cancer eller viss tumör, kan det vara möjligt att utveckla ett läkemedel specifikt för en specifik tumör eller enskild patient," sa Bardwell. "Det skulle tillåta oss att behandla dessa sjukdomar utan toxiciteten av grundläggande kemoterapi." Dessutom har många tumörer från samma cancer olika mutationer bland individer. Så småningom kan det vara möjligt att screena tumörer för att utveckla det bästa tillvägagångssättet för var och en.
Forskningen utfördes i samarbete med UCI School of Medicines avdelning för mikrobiologi och molekylär genetik och Stanford University School of Medicines avdelning för dermatologi.