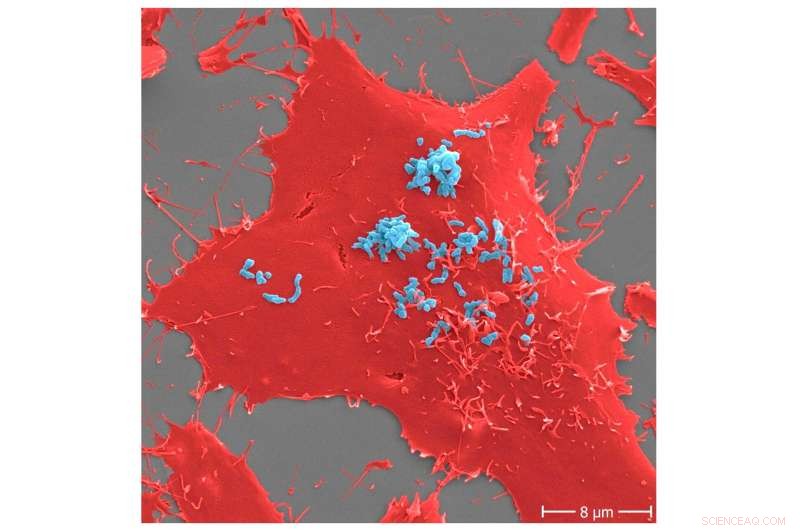
Adhesion av Bartonella henselae till mänskliga celler. B. henselae (stam Marseille) bakterier (ljusblå) i ett tidigt skede av infektionsprocess (30 min) till humana HeLa-229-celler (röda). Vidhäftning till värdceller förmedlas av specifika interaktioner mellan B. henselae-ytproteiner och komponenter i värdens extracellulära matris inklusive molekyler såsom fibronektin eller kollagen. Skalstång:8 μm. Kredit:Microbiology Spectrum (2022). DOI:10.1128/spectrum.00598-22
Forskare från University Hospital Frankfurt och Goethe University Frankfurt har reda ut hur bakterier fäster vid värdceller och därmed tagit det första steget mot att utveckla en ny klass av antibiotika.
Vidhäftningen av bakterier till värdceller är alltid det första, avgörande steget i utvecklingen av infektionssjukdomar. Syftet med denna vidhäftning av infektiösa patogener är att kolonisera värdorganismen (t.ex. människokroppen) och sedan utlösa en infektion, som i värsta fall kan sluta dödligt. En exakt förståelse av bakteriernas vidhäftning till värdceller är nyckeln till att hitta terapeutiska alternativ som blockerar denna kritiska interaktion i det tidigaste möjliga skedet av en infektion.
Kritisk interaktion med det humana proteinet fibronektin
I samarbete med andra forskare har forskare från University Hospital Frankfurt och Goethe University Frankfurt nu förklarat den exakta bakteriella vidhäftningsmekanismen med hjälp av den humanpatogena bakterien Bartonella henselae. Denna patogen orsakar "cat-scratch disease", en sjukdom som överförs från djur till människor. I ett internationellt samarbetsprojekt ledd av forskargruppen i Frankfurt ledd av professor Volkhard Kempf, dechiffrerades den bakteriella adhesionsmekanismen med hjälp av en kombination av in vitro adhesionstester och högkapacitetsproteomik. Proteomics är studiet av alla proteiner som finns i en cell eller en komplex organism.
I deras studie publicerad i Microbiology Spectrum , belyser forskarna en nyckelmekanism:den bakteriella vidhäftningen till värdcellerna kan spåras tillbaka till interaktionen av en viss klass av adhesiner – kallade "trimera autotransporteradhesiner" – med fibronektin, ett protein som ofta finns i mänsklig vävnad. Adhesiner är komponenter på ytan av bakterier som gör att patogenen kan fästa vid värdens biologiska strukturer. Homologer av adhesinet som här identifierats som kritiska finns också i många andra humanpatogena bakterier, såsom den multiresistenta Acinetobacter baumannii, som Världshälsoorganisationen (WHO) har klassat som högsta prioritet för forskning om nya antibiotika.
Toppmodern proteinanalys användes för att visualisera de exakta interaktionspunkterna mellan proteinerna. Dessutom var det möjligt att visa att experimentell blockering av dessa processer nästan helt förhindrar bakteriell vidhäftning. Terapeutiska tillvägagångssätt som syftar till att förhindra bakteriell vidhäftning på detta sätt skulle kunna representera ett lovande behandlingsalternativ som en ny klass av antibiotika (känd som "anti-ligander") i den ständigt växande domänen av multiresistenta bakterier.