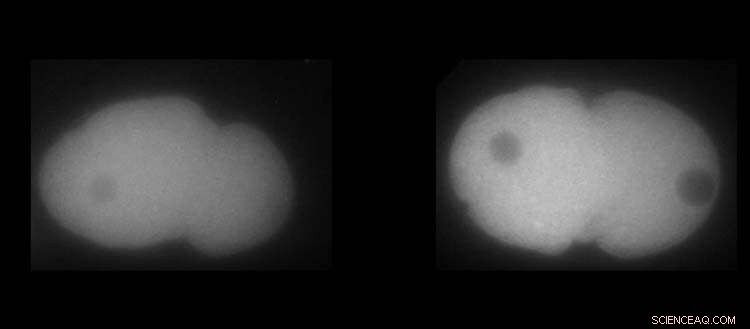
Till vänster, MEX-5-protein. Till höger, PLK-1-protein i C. elegans embryon. Vit visar den högre eller lägre närvaron av proteinerna. Kredit:UNIGE / Laboratoire Monica Gotta
Var och en av våra celler innehåller cirka 40 miljoner proteiner som tillsammans utför alla uppgifter som cellen behöver för att överleva. För en smidig verkan måste rätt proteiner koncentreras i specifika mängder, vid en specifik tidpunkt och på en specifik plats. Men att etablera en så delikat fördelning kräver en extremt exakt process, som sker vid små rumsliga upplösningar som standardcellbiologiska verktyg ofta inte kan upptäcka. För att förstå hur denna mekanism fungerar utvecklade forskare från universitetet i Genève (UNIGE) ett nytt tillvägagångssätt som kombinerar genetik och cellbiologiska experiment med fysisk modellering. Med hjälp av specifika algoritmer simulerade de bildandet av proteingradienter i 3D och genom tiden och kunde förklara dessa komplexa mekanismer. Dessutom kan deras innovativa modell anpassas till andra biologiska system för att undersöka proteindynamik. Dessa resultat kan läsas i Proceedings of the National Academy of Sciences .
Som en droppe bläck i ett glas vatten kan proteiner diffundera och fördela sig jämnt i cellen. Men för en hel del uppgifter behöver proteiner bilda gradienter. "Proteingradienter, som uppstår från den ojämna fördelningen av proteiner i specifika cellulära områden, är centrala för många cellulära och organismfunktioner", förklarar Monica Gotta, professor vid institutionen för cellfysiologi och metabolism och vid Translational Research Center i Onco- hematologi (CRTOH) vid UNIGE Medicinska fakulteten, som ledde detta arbete. "Till exempel är proteingradienter viktiga för celldifferentiering, den process genom vilken de olika celltyperna som utgör en komplex organism kommer fram från en unik cell, det befruktade ägget."
Användning av slumpmässighet
PLK-1-proteinet, en nyckelregulator för celldelning, är känt för att vara mer koncentrerat på embryots främre sida. Men hur kan denna mekanism sättas på plats, och vad skulle konsekvensen bli om den minsta detalj gick snett? Eftersom biologins vanliga verktyg inte var tillräckliga för att besvara denna fråga var Monica Gotta glad över att välkomna en fysiker till sitt team, Sofia Barbieri, postdoktor vid institutionen för cellfysiologi och metabolism vid UNIGE Medicinska fakulteten.
"Genom att sammanställa allt känt om denna biologiska process och nya hypoteser om mekanismerna utvecklade jag en statistisk modell för proteingradientbildning baserad på probabilistisk matematik", förklarar Sofia Barbieri. "Jag tog till specifika beräkningsalgoritmer, kallade Monte Carlo-simuleringar, uppkallade efter den berömda spelstaden." Dessa algoritmer används för att modellera fenomen med en hög nivå av komplexitet, såsom finans, handel eller partikelfysik.
Teamet kunde simulera proteingradienter, inte bara i 3D, utan också genom tiden. En sådan modell krävde dock flera iterationer mellan parameteroptimering och jämförelse med biologiska data. Forskarna byggde en första version av modellen med alla kända fysiska och biologiska element i systemet, och introducerade sedan specifika parametrar som var nödvändiga för att testa flera hypoteser om de okända variablerna. De simulerade möjliga fysiska och biologiska resultat som beräkningsmässigt reproducerade proteindynamiken och gradientetableringen i cellen, och testade dem i verkligheten med in vivo-experiment med embryon från en liten mask, C. elegans-nematoden.
Intrikat proteininteraktion på spel
Tack vare det kontinuerliga samspelet mellan modellering och cellbiologi kunde UNIGE-forskarna fastställa hur PLK-1-gradienten etablerades och upprätthölls över tid. I själva verket måste PLK-1 dynamiskt binda till och lossa från MEX-5, ett annat protein som är avgörande för utvecklingen i C. elegans embryot, för att motverka dess naturliga tendens att diffundera homogent i cellen. MEX-5 har verkligen förmågan att ändra sin diffusivitet beroende på dess position i cellen och att interagera med andra proteiner, vilket är viktigt för att berika PLK-1 där det behövs. "Men ganska överraskande är MEX-5 inte så effektiv i sin uppgift, eftersom en stor mängd PLK-1 inte är bunden till MEX-5", påpekar Sofia Barbieri.
Denna studie ger en unik kvantitativ modell för att förstå dynamiska interaktioner mellan proteiner och kan anpassas till andra celler eller proteiner för vilka de komplexa mekanismerna inte kan testas med vanliga cellbiologiska experiment. "Vårt arbete visar att tvärvetenskapliga samarbeten är viktigare och viktigare för att avancera i forskningen", avslutar Monica Gotta.