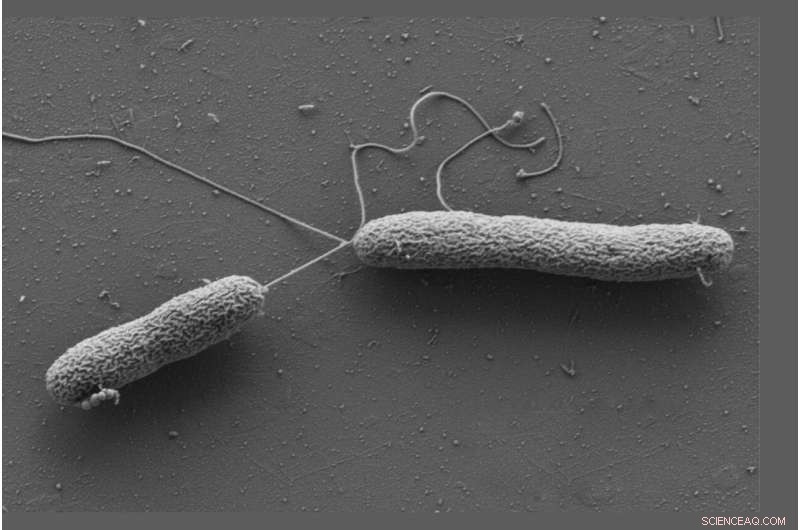
Celler av Vibrio campbellii rör sig med hjälp av långa flageller. Kredit:Wanner/Jung, LMU
Hos människor och djur är katekolaminer som epinefrin, noradrenalin och dopamin vanliga stresshormoner. Stress kan öka kroppens mottaglighet för bakteriella infektioner. I laboratoriet stimulerar stresshormoner tillväxten av olika patogener. Detta hade redan observerats i Salmonella (Salmonella enterica serovar Typhimurium) och andra tarmbakterier, Escherichia coli och det orsakande medlet för kolera, Vibrio cholerae. Vidare gör adrenalin och noradrenalin det lättare för bakterier att infektera kroppens celler. Och dessa hormoner påverkar också biosyntesen av virulensfaktorer, vilket gör att patogener kan fästa vid, penetrera och förstöra celler.
"Vi misstänkte därför att vissa bakterier använder sådana hormoner som signaler för att känna igen den eukaryota värdmiljön", säger LMU-mikrobiologen professor Kirsten Jung. "Men den molekylära grunden var inte känd." Tillsammans med professor Stephan A. Sieber från Münchens tekniska universitet (TUM) och andra forskare har Jung nu identifierat bindningsstället för adrenalin och adrenalinderivatet fenylefrin i bakterien Vibrio campbellii. Som teamet rapporterar i PNAS , är målet för båda molekylerna proteinet CheW. "Den biologiska betydelsen av mekanismen är att bakterier till exempel känner igen att de inte längre finns i havsvatten, utan i tarmen på en värd", förklarar Jung.
Studier med modellorganismen V. campbellii
"Vi ville veta hur bakterier känner igen katekolaminer som signalmolekyler", säger LMU-forskaren. "Vilka receptorer styr denna process?" Hennes experiment bestod av flera individuella steg.
För studien utvecklade Sieber en metod för att kemiskt modifiera epinefrin och fenylefrin, så att forskarna direkt kunde isolera komplex från katekolaminerna och de bundna bakterieproteinerna. En förutsättning för experimenten var att de nya föreningarna inte skulle ha några biologiska egenskaper som de omodifierade molekylerna inte hade. Jungs grupp gjorde laboratorieexperiment för att visa att det var så. Adrenalin binder järn, medan adrenalinderivatet fenylefrin inte gör det. Med sitt val av föreningar ville forskarna utesluta effekter som uppstår när bakterierna får bättre tillgång på järn.
Jung och Sieber arbetade med Vibrio campbellii som en modellorganism. Den marina bakterien infekterar fisk, räkor, bläckfisk och många andra marina ryggradslösa djur. De tillsatte Vibrio campbellii till de kemiskt modifierade katekolaminerna och lyserade cellerna. Därefter extraherade de från lysatet alla proteiner till vilka en molekyl hade bundits och karakteriserade dem genom att använda proteomanalys. Detta resulterade i en speciell anrikning av det lösliga kemotaxiproteinet CheW.
Därefter isolerade Jungs grupp CheW-proteinet direkt från bakterier, renade det och mätte dess bindningsaffinitet till katekolaminer. I processen upptäckte forskarna något överraskande:hormonerna binder inte till själva kemoreceptorerna, som man ursprungligen förväntade sig, utan till kopplingsproteinet CheW, som ligger mellan receptorer och en signaltransduktionskaskad. Hela detta stimulusuppfattningssystem styr bakteriens rörelse i en kemisk gradient.
"Vår studie ger nya insikter om bakteriers kommunikation med sin värd", sammanfattar Jung. "Vi kunde visa att bakteriers simbeteende modifieras av värdhormoner, som kontrolleras av CheW." Motilitet, och i synnerhet riktad motilitet, är avgörande för värdkolonisering, eftersom bakterier medvetet försöker kolonisera en organism och erövra alla nischer. I nästa steg vill Jung nu ta reda på om samma mekanism kan upptäckas hos andra bakterier.