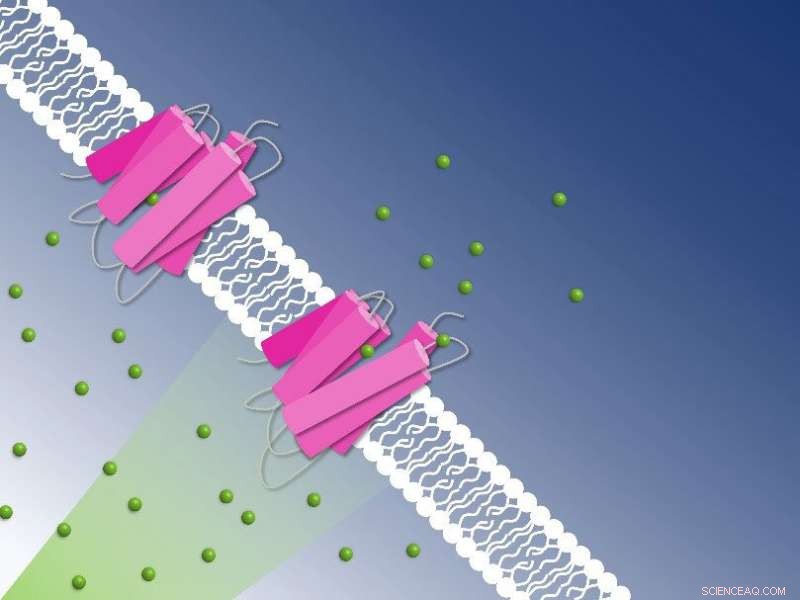
Fotoaktiv klorid som pumpar genom cellmembranet fångad av tidsupplöst seriell kristallografi:Kloridjoner (gröna sfärer) transporteras över cellmembranet av NmHR-kloridpumpen (rosa). Kredit:Guillaume Gotthard och Sandra Mous
Många bakterier och encelliga alger har ljusdrivna pumpar i sina cellmembran:proteiner som ändrar form när de exponeras för fotoner så att de kan transportera laddade atomer in eller ut ur cellen. Tack vare dessa pumpar kan deras encelliga ägare anpassa sig till miljöns pH-värde eller salthalt.
En sådan bakterie är Nonlabens marinus, som först upptäcktes 2012 i Stilla havet. Det har bland annat ett rhodopsinprotein i sitt cellmembran som transporterar kloridanjoner från utsidan av cellen till dess insida. Precis som i det mänskliga ögat, isomeriserar en retinal molekyl bunden till proteinet när den utsätts för ljus. Denna isomerisering startar pumpningsprocessen. Forskare fick nu detaljerad inblick i hur kloridpumpen i Nonlabens marinus fungerar.
Studien leddes av Przemyslaw Nogly, en gång postdoc vid PSI och nu Ambizione Fellow och gruppledare vid ETH Zürich. Med sitt team kombinerade han experiment vid två av PSI:s storskaliga forskningsanläggningar, Swiss Light Source SLS och röntgenfrielektronlasern SwissFEL. Långsammare dynamik i millisekundsintervallet undersöktes via tidsupplöst seriell kristallografi vid SLS medan snabbare, upp till pikosekunder, händelser fångades in vid SwissFEL – sedan sattes båda datauppsättningarna samman.
"I ett dokument utnyttjar vi fördelarna med två toppmoderna anläggningar för att berätta hela historien om denna kloridpump", säger Nogly. Jörg Standfuss, medförfattare till studien som byggde upp ett PSI-team dedikerat till att skapa sådana molekylära filmer, tillägger att "denna kombination möjliggör förstklassig biologisk forskning som bara skulle vara möjlig på väldigt få andra platser i världen förutom PSI."

Rosa kristaller avslöjar mekanismen för kloridtransport över cellmembranet:Med hjälp av tidsupplöst seriell kristallografi avslöjade de rosa NmHR-kristallerna jonbindningsställen i kloridtransportören och pumpdynamik efter fotoaktivering. Detta gjorde det möjligt för forskare att dechiffrera kloridtransportmekanismen. Kredit:Sandra Mous
Inget återflöde
Som studien har visat attraheras kloridanjonen av en positivt laddad del av rhodopsinproteinet i Nonlabens marinus cellmembran. Här kommer anjonen in i proteinet och binder slutligen till en positiv laddning vid näthinnemolekylen inuti. När retinal isomeriseras på grund av ljusexponering och vänder på sig drar den med sig kloridanjonen och transporterar den på så sätt en bit längre in i proteinet. "Det här är hur ljusenergi omvandlas direkt till kinetisk energi, vilket utlöser det allra första steget i jontransporten", säger Sandra Mous, doktor. student i Noglys grupp och första författare till tidningen.
Att vara på andra sidan av näthinnemolekylen nu, har kloridjonen nått en punkt utan återvändo. Härifrån går det bara längre in i cellen. En aminosyraspiral slappnar också av när klorid rör sig, och hindrar dessutom passagen tillbaka utanför. "Under transporten ser två molekylära grindar alltså till att klorid bara rör sig i en riktning:inuti", säger Nogly. En pumpprocess tar totalt cirka 100 millisekunder.
För två år sedan avslöjade Jörg Standfuss, Przemyslaw Nogly och deras team mekanismen för en annan ljusdriven bakteriepump:natriumpumpen från Krokinobacter eikastus. Forskare är angelägna om att upptäcka detaljerna i ljusdrivna pumpar eftersom dessa proteiner är värdefulla optogenetiska verktyg:genetiskt modifierade till däggdjursneuroner gör de det möjligt att kontrollera neuronernas aktiviteter med ljus och på så sätt forska om deras funktion.