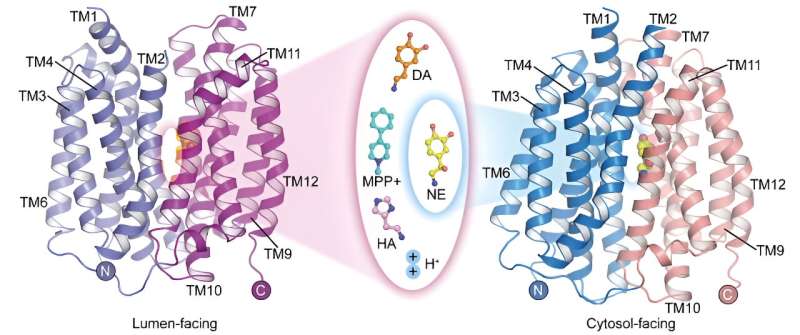
Vesikulär monoamintransportör 2 (VMAT2) är det enda transportproteinet i det centrala nervsystemet som förmedlar lagringen av monoaminneurotransmittorer. Det spelar en avgörande roll för att förmedla nervimpulsöverföring och neuroskydd.
För närvarande är mekanismerna genom vilka VMAT2 känner igen och transporterar flera strukturellt olika monoaminneurotransmittorer och Parkinsons sjukdomsinducerare MPP + är inte klara, och den molekylära mekanismen för protonkopplad substrattransport behöver också utforskas ytterligare.
I en studie publicerad i Cell Research den 22 maj har en forskargrupp ledd av prof. Zhao Yan från Institute of Biophysics vid den kinesiska vetenskapsakademin (CAS), i samarbete med prof. Jiang Daohua från Institute of Physics of CAS, rapporterat apo-strukturen hos människan vesikulär monoamintransportör 2 (hVMAT2) vid lågt pH, de komplexa strukturerna av vesiklar som möter dopamin, noradrenalin, histamin och neurotoxinet MPP + bindning, och den komplexa strukturen av noradrenalinbindning i det cytosolvända tillståndet.
Dessa strukturer avslöjar den strukturella grunden för VMAT2-substratigenkänning och förfinar den molekylära mekanismen för protonkopplad substrattransport ytterligare.
Även om noradrenalin, dopamin, serotonin och MPP + har olika molekylära strukturer visar de komplexa strukturerna av VMAT2 som binder till dessa substrat att de alla binder till liknande positioner på transportproteinet. Emellertid leder subtila skillnader i vissa funktionella grupper av dessa substrat till signifikanta och kritiska skillnader i deras interaktioner och bindningssätt med transportproteinet. Dessa skillnader illustrerar hur VMAT2 effektivt känner igen olika substratmolekyler.
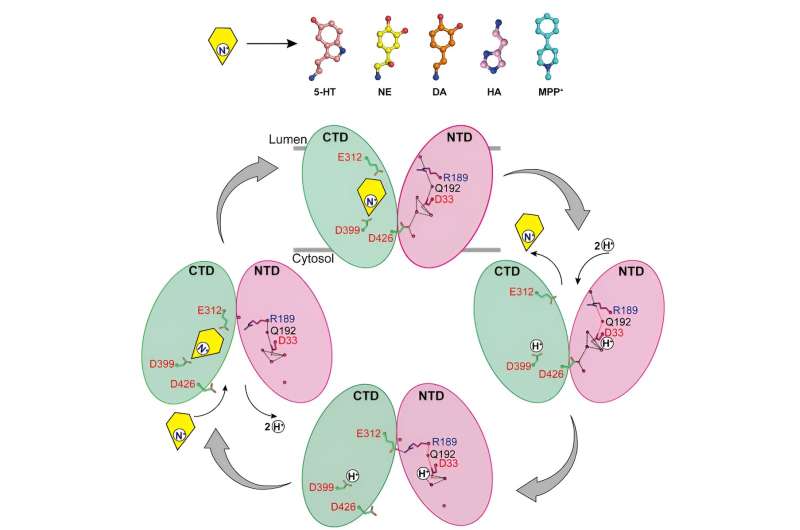
Forskarna rapporterade strukturerna för noradrenalin som binder till VMAT2 i olika konformationer, inklusive de cytosolvända och vesikelvända konformationerna.
Trots betydande konformationsförändringar i VMAT2 förblir substratbindningsfickan för noradrenalin relativt stabil under denna process, utan några signifikanta förändringar i interaktioner med omgivande rester. Denna smarta konformationsövergång är avgörande för funktionen hos VMAT2.
Genom att analysera strukturerna för VMAT2 vid olika pH-förhållanden, bekräftades det att D33 kan vara en annan viktig protonationsplats.
Genom att noggrant analysera de mekanismer genom vilka VMAT2 känner igen olika strukturellt olika monoaminneurotransmittorer och neurotoxiner, föreslår detta arbete en molekylär modell för VMAT2 konformationsförändringar och förfinar ytterligare den specifika mekanismen för protonkopplad substrattransport.
Dessa fynd ger värdefulla insikter för en omfattande förståelse av VMAT2-transportsättet, berikar kunskapssystemet för den stora facilitatorn för superfamiljens substrattransport och lägger en viktig grund för läkemedelsutveckling och optimering.
Mer information: Di Wu et al, Strukturella ögonblicksbilder av mänsklig VMAT2 avslöjar insikter i substratigenkänning och protonkopplingsmekanism, Cell Research (2024). DOI:10.1038/s41422-024-00974-9
Journalinformation: Cellforskning
Tillhandahålls av Chinese Academy of Sciences