En enkel och robust strategi utvecklad av KAUST-forskare kan bidra till att förbättra säkerheten och noggrannheten för CRISPR-genredigering, ett verktyg som redan är godkänt för klinisk användning för behandling av ärftliga blodsjukdomar.
Detta tillvägagångssätt tar itu med ett kritiskt problem med CRISPR-teknik:handlingen att skära genomet vid specifika punkter och sedan återförena det, vilket i sig riskerar att skada DNA:t på ett sätt som kan orsaka storskaliga och oförutsägbara störningar.
I hopp om att mildra detta problem undersökte ett team ledd av Mo Li, en stamcellsbiolog vid KAUST, DNA-reparationsvägar som leder till stora genomiska deletioner efter CRISPR-redigering i mänskliga stamceller. Studien är publicerad i tidskriften BMC Biology .
Deras analys ledde dem till en process som kallas mikrohomologi-medierad slutkoppling (MMEJ), en felbenägen mekanism som, även om den kan fixa avbrott i DNA, ofta lämnar efter sig stora deletioner i dess kölvatten.
Forskarna förhörde olika gener som var inblandade i denna MMEJ-process och fann två som spelade centrala – men motsatta – roller i dessa oönskade raderingshändelser.
En gen, kallad POLQ, visade sig förvärra risken för stora deletioner efter CRISPR-redigering. Den andra, kallad RPA, dök upp som en genomisk väktare med skyddande effekter.
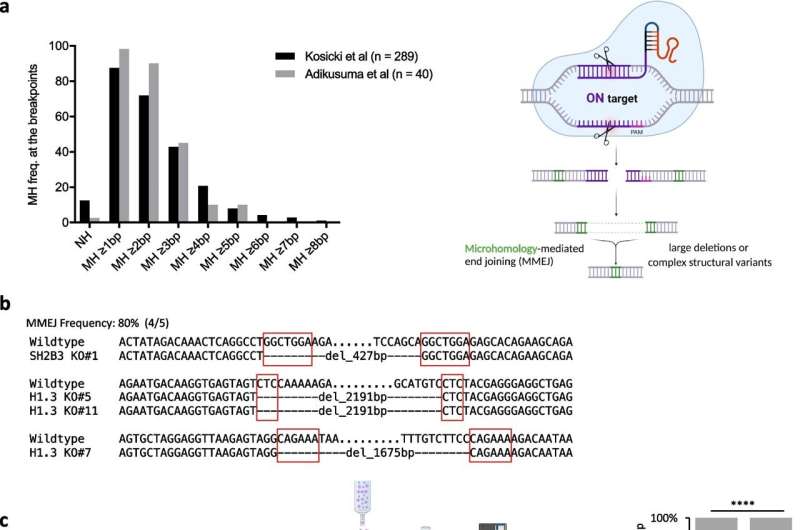
Genom att manipulera dessa gener, antingen med läkemedel som hämmar POLQ eller genom genetiska tekniker som ökar uttrycket av RPA, kunde KAUST-teamet sedan minska förekomsten av skadliga stora deletioner utan att kompromissa med effektiviteten av genomredigering och på så sätt bevara den genomiska integriteten hos redigerade stamceller.
"Detta lättanvända tillvägagångssätt kan minska risken för att dessa skadliga stora DNA-deletioner inträffar", säger Baolei Yuan, en före detta Ph.D. student i Lis labb och en av studiens arkitekter, tillsammans med Chongwei Bi och Yeteng Tian från Lis labb.
Dessutom visade sig samma interventioner förbättra effektiviteten av homologi-riktad reparation, en mekanism känd för sin förmåga att möjliggöra exakt genomredigering utan att lägga till oavsiktliga mutationer.
Detta var uppenbart i experiment som involverade stamceller som bar mutationer i två gener kopplade till sicklecellssjukdom och Wiskott-Aldrichs syndrom, båda ärftliga blodsjukdomar. Genom att modulera POLQ eller RPA uppnådde forskarna mycket exakt och tillförlitlig genredigering i dessa celler.
Fynden markerar ett betydande steg framåt i att förfina CRISPR-teknologin, hävdar Li. "Det är verkligen spännande eftersom det betyder att vi kommer närmare säkrare och mer effektiva behandlingar för genetiska sjukdomar", säger han.
Med en provisorisk patentansökan inlämnad för denna innovativa strategi fortsätter teamet att utforska mekanismerna bakom ett bredare spektrum av oönskade mutationer och att finslipa sina tekniker för att göra CRISPR säkrare och effektivare.
"Att uppnå både hög effektivitet och säkerhet är fortfarande en utmaning som kräver ytterligare utveckling", säger Li, "och vårt laboratorium ligger fortfarande i framkant och letar efter nya lösningar."
Mer information: Baolei Yuan et al, Modulering av den mikrohomologimedierade ändkopplingsvägen undertrycker stora deletioner och förbättrar homologiriktad reparation efter CRISPR-Cas9-inducerade DNA-avbrott, BMC Biology (2024). DOI:10.1186/s12915-024-01896-z
Journalinformation: BMC Biology
Tillhandahålls av King Abdullah University of Science and Technology