En gemensam forskargrupp ledd av Dr. Akira Kunitomi, en före detta postdoktor vid CiRA (för närvarande forskare vid Gladstone Institute of Cardiovascular Disease), och ID Pharma Co., Ltd., har avslöjat den avgörande rollen för oocytspecifik länkhiston , H1FOO, för att förbättra omprogrammeringseffektiviteten och homogeniteten till förberedda och naiva pluripotenta tillstånd. Studien publiceras i Stem Cell Reports .
Medan konventionell omprogrammering producerar mänskliga inducerade pluripotenta stamceller (iPS) med "primade" egenskaper, som liknar postimplantations epiblaster med begränsad potential att förvandlas till extraembryonala vävnader, uppvisar det "naiva" pluripotenta tillståndet egenskaper som mer liknar preimplantations epiblastceller och mus iPS-celler , vilket gör att de kan differentiera sig till både embryonala och extraembryonala linjer.
Även om grundade och naiva mänskliga iPS-celler har möjliggjort biomedicinska framsteg som tidigare var ofattbara, är en huvudutmaning när det gäller iPS-celler för grundforskning och medicinska ändamål deras heterogenitet. Traditionella omprogrammeringsmetoder förblir en stokastisk process, och därför fortsätter många forskare att söka effektivare och mer exakta sätt att generera homogena iPS-celler.
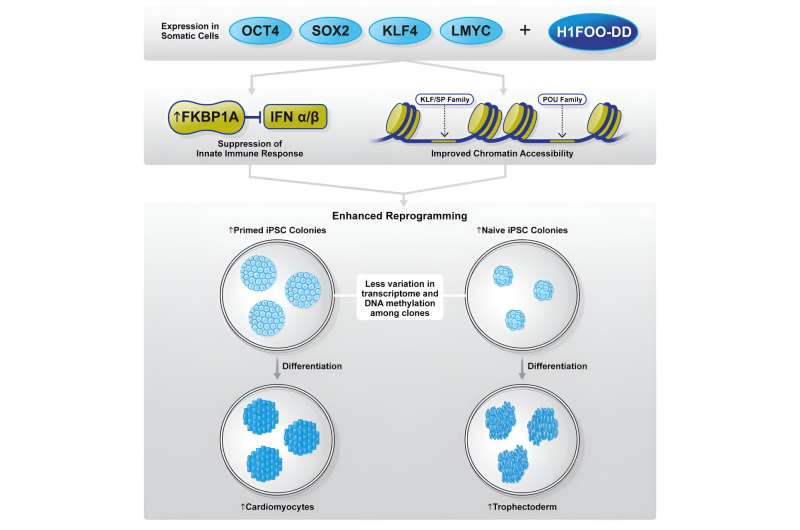
I sin senaste studie undersökte det samarbetande forskarteamet potentialen hos den modernsspecifika länkhistonen H1FOO som en kandidatfaktor för att förfina omprogrammeringsprocessen. Forskarna konstruerade H1FOO genom att fästa en destabiliseringsdomän (DD) så att de kunde manipulera dess nedbrytning kemiskt och noggrant reglera dess nivåer.
När de användes i kombination med Yamanaka-faktorerna (OSKL, MYC ersattes av LMYC för att undvika tumörbildning), fann de att H1FOO-DD förbättrade effektiviteten för generering av iPS-celler avsevärt, oavsett vilket genleveranssystem som används.
Även om genuttryck och epigenetiska analyser inte identifierade några meningsfulla skillnader mellan omprogrammering med endast OSKL eller i kombination med H1FOO-DD, avslöjade de dock att genom att använda H1FOO-DD, visade de oberoende genererade iPS-cellerna ett mer liknande genuttrycksmönster , vilket indikerar förbättringar av homogenitet och reproducerbarhet.
Noterbart antydde en analys av gener med mycket varierande uttryck mellan oberoende iPS-cellinjer att H1FOO minskade sådan variabilitet med nästan hälften. Avgörande är att många av dessa gener är involverade i reglering av genuttryck, vilket visar H1FOO-DDs förmåga att styra omprogrammeringsprocessen mer strikt.
Vidare observerade forskarna också att iPS-celler genererade via omprogrammering med H1FOO-DD var bättre på att differentiera till endoderm, ett av tre primära könsskikt, och kardiomyocyter (en mesodermal celltyp).
Forskargruppen fortsatte sin undersökning genom att undersöka de underliggande mekanismerna genom vilka H1FOO-DD förbättrar omprogrammering. Genom encellig RNA-sekvensering (scRNA-seq)-analys fann forskarna att omprogrammering med H1FOO-DD inte bara ledde till tidigare och högre uttryck av pluripotensrelaterade gener utan även undertryckte uttrycket av gener relaterade till medfödd immunsvar, inflammation och apoptos (programmerad celldöd).
I synnerhet ökade H1FOO-DD andelen celler som kategoriseras som framgångsrikt omprogrammerade samtidigt som cellsubpopulationer som anses ha genomgått ofullständig eller misslyckad omprogrammering minskade.
Med tanke på H1FOO:s roll som en kromatinremodelleringsfaktor undersökte forskarna också tillgängligheten till kromatinregioner. I enlighet med resultaten från genuttrycksanalys öppnades kromatinregioner, särskilt de närliggande pluripotensmarkörerna, tidigare och var mer tillgängliga när H1FOO-DD inkluderades som en omprogrammeringsfaktor.
Ytterligare analys visade att POU- och KLF/SP-transkriptionsfaktorfamiljer aktiverades tidigare under omprogrammeringsprocessen av H1FOO-DD. Dessa resultat tyder på att H1FOO-DD hjälper till att koordinera omprogrammering mer effektivt och i tid för att förbättra genereringen av iPS-celler.
Forskarna fokuserade sedan på nedströms effektorer som hjälper till att mediera de positiva effekterna av H1FOO-DD på generering av iPS-celler genom att undersöka gener med differentiellt uttryck tidigt under omprogrammering. Genom denna analys identifierade de 19 uppreglerade och två nedreglerade gener när H1FOO-DD inkluderades som en omprogrammeringsfaktor.
Forskargruppen undersökte dessa gener individuellt för att avgöra om de påverkar primad och naiv omprogrammering och fann att FKBP1A eller APOE-överuttryck förbättrar omprogrammering. Eftersom APOE tidigare rapporterats vara starkt uttryckt under omprogrammering, fokuserade forskarna sin uppmärksamhet på FKBP1A i hopp om att avslöja nya molekylära mekanismer bakom framgångsrik omprogrammering.
Noterbart fann de att även om omprogrammering med enbart OSKL ökar FKBP1A-uttrycket, ökar införandet av H1FOO-DD det dramatiskt. Denna observation stöddes ytterligare genom att ompröva genuttrycket och kromatintillgänglighetsdata som de redan hade samlat in.
FKBP1A är ett immunofilin involverat i immunsuppression som kan interagera med och hämma TGFBR1, vilket i sin tur främjar mesenkymal-till-epitelial övergång (MET) och förbättrar omprogrammeringseffektiviteten.
Forskarna antog således att både FKBP1A fungerar i att undertrycka medfödd immunitet och att hämma TGFBR1-medierad MET) sannolikt är ansvariga för förbättringen av omprogrammeringseffektiviteten genom H1FOO-DD.
Noterbart fann de att omprogrammering via en kombination av OSKL- och FKBP1A-överuttryck ledde till jämförbar TGFBR1-dämpning, MET-förstärkning, medfödd immunsvarsdämpning och apoptos, som när H1FOO-DD användes för att initiera omprogrammering.
Slutligen, eftersom tidigare genuttrycksanalys indikerade att förutom att förstärka omprogrammering, H1FOO-DD också inducerade uttrycket av naiva tillståndsmarkörer, undersökte forskarna om H1FOO-DD också är kapabel att främja omprogrammering till det naiva tillståndet. Faktum är att de observerade att H1FOO-DD-inkludering avsevärt förbättrade naiv iPS-cellgenerering.
Dessutom, analogt med förberedd omprogrammering, förstärkte H1FOO-DD omprogrammeringsprocessen genom att koordinera mer enhetlig gen- och epigenetisk reglering i cellerna. Funktionellt sett, mätt med metabolisk aktivitet och X-kromosomreaktivering, producerade omprogrammering med H1FOO-DD naiva iPS-celler mer lika naiva embryonala stamceller eller preimplantationsblastocyster än när OSKL användes ensamt.
Sammanfattningsvis identifierade kombinerade ansträngningar från det gemensamma forskarteamet H1FOO-FKBP1A-axeln som ett sätt att omprogrammera celler med större effektivitet och precision. Dessa fynd kommer att visa sig ha en enorm inverkan på generering av iPS-celler för både grundläggande vetenskaplig forskning och kliniska tillämpningar.
Mer information: Akira Kunitomi et al, H1FOO-DD främjar effektivitet och enhetlighet vid omprogrammering till naiv pluripotens, Stam Cell Reports (2024). DOI:10.1016/j.stemcr.2024.04.005
Journalinformation: Stamcellsrapporter
Tillhandahålls av Kyoto University