Antibiotiska läkemedel blev en populär behandling för bakterieinfektioner i början av 1900-talet och dök upp som ett transformerande verktyg för människors hälsa. Under mitten av seklet utvecklades regelbundet nya antibiotika under medicinens guldålder.
Men sedan utvecklades bakterier. De hittade nya sätt att undvika antibiotikabehandlingar, vilket gjorde många oanvändbara. När nya antibiotikakällor torkade upp eskalerade bakterieinfektioner till dagens globala hälsokris av antibiotikaresistens.
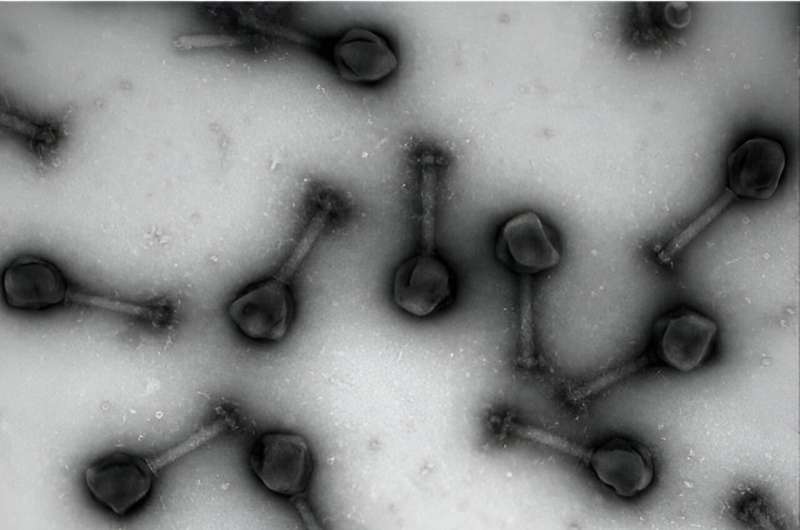
Forskare ser nu till en ovanlig allierad, virus, för att hjälpa till att motverka detta ökande hot. Nyligen har forskare fokuserat på virus som kallas bakteriofager som ett nytt verktyg för att behandla och avväpna antibiotikaresistenta bakterier. Särskild uppmärksamhet har lagts på "jumbo"-fager – virus som nyligen upptäckts ha extremt stora genom – som skulle kunna utnyttjas som speciella leveransmedel som inte bara kan döda bakterier utan kan konstrueras för att leverera antibiotika direkt till infektionskällan.
Men för att kunna leverera ny terapi genom fager måste forskare först förstå den extraordinära biologiska sammansättningen och mekanismerna inuti dessa mystiska virus.
Forskare från University of California San Diego School of Biological Sciences och deras kollegor vid UC Berkeleys Innovative Genomics Institute och Chulalongkorn University i Bangkok har tagit ett betydande steg framåt i att dechiffrera flera nyckelfunktioner inom jumbofager.
"Dessa jumbofager har stora genom som i teorin skulle kunna manipuleras för att bära nyttolaster som mer effektivt dödar bakterier", säger Joe Pogliano, professor vid UC San Diego vid School of Biological Sciences och senior författare till en ny artikel publicerad i Proceedings of the National Academy of Sciences . "Problemet är att deras genom är inneslutet så det är inte lätt att komma åt. Men nu har vi upptäckt några av dess nyckelelement."
Som beskrivits i artikeln fokuserade forskning ledd av School of Biological Sciences doktorand Chase Morgan på jumbo Chimalliviridae-fager som visade sig replikera inuti bakterier genom att bilda ett fack som liknar kärnan inuti cellerna hos människor och andra levande organismer. Chimalliviridaes kärnliknande fack separerar och importerar selektivt vissa proteiner som gör att den kan replikera inuti värdbakterierna. Men hur denna process utvecklades hade varit en förbryllande del av processen.
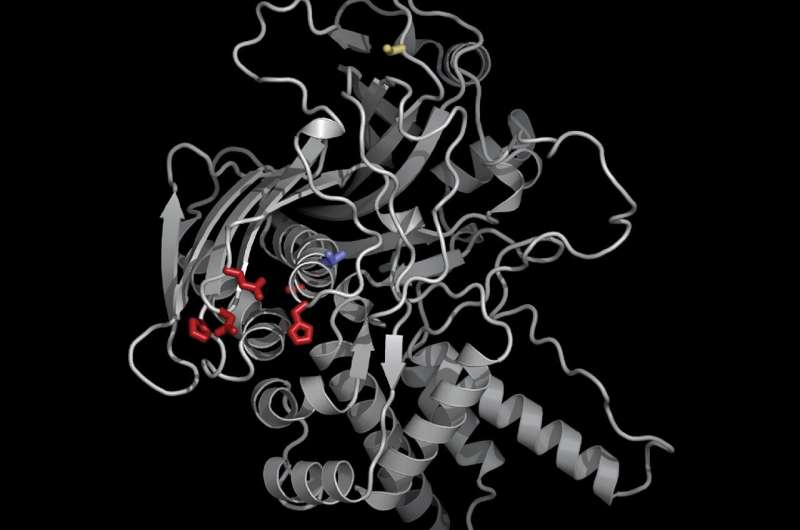
Med hjälp av nya genetiska och cellbiologiska verktyg identifierade Morgan och hans kollegor ett nyckelprotein, som de kallade "proteinimportör av Chimallivirus A" eller PicA, som fungerar som en typ av nattklubbshoppare, som selektivt trafikerar proteiner genom att ge inträde i kärnan för vissa men nekar åtkomst för andra. PicA, fann de, koordinerar fraktproteinhandel över det skyddande skalet av fagkärnan.
"Bara det faktum att det här viruset kan sätta upp denna otroligt komplexa struktur och transportsystem är verkligen fantastiskt och sådana som vi inte har sett förut," sa Morgan. "Det vi tänker på som komplex biologi är vanligtvis reserverat för högre livsformer med människor och våra tiotusentals gener, men här ser vi funktionellt analoga processer i ett jämförelsevis litet viralt genom på bara cirka 300 gener. Det är förmodligen den enklaste selektiva transportsystem som vi känner till."
Med hjälp av CRISPRI-ART, ett programmerbart RNA-verktyg för att studera genom, kunde forskarna visa att PicA är en viktig komponent i Chimalliviridae kärnutveckling och replikeringsprocessen.
"Utan enkelheten och mångsidigheten hos RNA-inriktade CRISPR-teknologier skulle det vara nästan omöjligt att direkt ställa och svara på dessa frågor. Vi är verkligen glada över att se hur dessa verktyg reder ut mysterierna som kodas av faggenom", säger medförfattaren Ben Adler, en postdoktor som arbetar under Nobelprisvinnande CRISPR-pionjären Jennifer Doudna.
Bakterier och virus har deltagit i en typ av kapprustning i miljarder år, var och en har utvecklats för att motverka den andras anpassningar. Forskarna säger att det sofistikerade PicA-transportsystemet är ett resultat av den intensiva, pågående evolutionära konkurrensen. Systemet har utvecklats till att vara både mycket flexibelt och mycket selektivt, och tillåter endast viktiga fördelaktiga element inuti kärnan. Utan PicA-systemet skulle bakteriernas defensiva proteiner arbeta sig in och sabotera virusets replikationsprocess.
Sådan information är viktig eftersom forskare med Emerging Pathogens Initiative och UC San Diegos Center for Innovative Phage Applications and Therapeutics strävar efter att lägga grunden för att så småningom genetiskt programmera fager för att behandla en mängd olika dödliga sjukdomar.
"Vi hade verkligen ingen förståelse för hur proteinimportsystemet fungerade eller vilka proteiner som var inblandade tidigare, så den här forskningen är det första steget i att förstå en nyckelprocess som är avgörande för att dessa fager ska lyckas replikera", säger School of Biological Sciences doktorand Emily Armbruster, en pappersmedförfattare. "Ju mer vi förstår dessa viktiga system, desto bättre kommer vi att kunna konstruera fager för terapeutisk användning."
Framtida mål för sådana genetiskt programmerade virus inkluderar Pseudomonas aeruginosa-bakterier, som är kända för att orsaka potentiellt dödliga infektioner och utgöra risker för patienter på sjukhus. Andra lovande mål inkluderar E. coli och Klebsiella som kan orsaka kroniska och återkommande infektioner och i vissa fall komma in i blodomloppet vilket kan vara livshotande.
Mer information: Chase J. Morgan et al, En väsentlig och mycket selektiv proteinimportväg kodad av kärnbildande fag, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2321190121
Journalinformation: Proceedings of the National Academy of Sciences
Tillhandahålls av University of California - San Diego